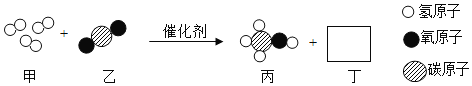
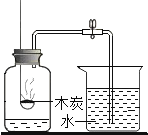
题目内容
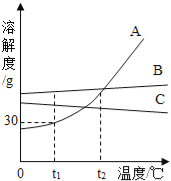
【题目】稀NaOH溶液与稀盐酸反应过程中温度和pH的变化如图所示。下列说法正确的是( )

A. 该实验是将稀盐酸滴入稀NaOH溶液
B. 稀NaOH溶液与稀盐酸反应为吸热反应
C. 在40s到50s某时刻,两溶液恰好完全反应
D. 在温度达到最高值前,溶液中只有![]() 和
和![]() 两种离子
两种离子
【答案】C
【解析】
A、图象中pH值的变化是从小于7逐渐的增大到大于7,可知原溶液显酸性,然后不断的加入碱性溶液,使pH增大,说明是把氢氧化钠溶液滴加到稀盐酸中,故选项说法错误;
B、由稀NaOH溶液与稀盐酸反应过程中温度变化图,稀NaOH溶液与稀盐酸反应为放热反应,故选项说法错误;
C、在40s到50s某时刻,温度最高,在40s到50s某时刻,两溶液恰好完全反应,故选项说法正确;
D、在温度达到最高值前,稀盐酸有剩余,溶液中除了Na+和Cl-两种离子,还含有氢离子,故选项说法错误。
故选C。

 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案【题目】以菱锌矿(主要成分是ZnCO3,杂质为Fe2O3、FeO、CuO)为原料制备七水硫酸锌(ZnSO47H2O),同时得到铁红副产品,其工艺流程如图,回答下列问题:

(1)“堆浸”前将菱锌矿粉粹成细颗粒,其目的是_____________________;
(2)若实验室用质量分数为98%的硫酸配制200g25%的硫酸,需要98%的硫酸质量为_____g(列出算式即可),需要用到的玻璃仪器有胶头滴管、玻璃棒、烧杯和________,此处玻璃棒的作用是____;
(3)物质X是___________,除铜时发生的反应属于________________反应(填基本反应类型);
(4)“氧化”中加入H2O2的目的是在硫酸的作用下将溶液中的FeSO4转化成Fe2(SO4)3,反应的化学方程式:_______________。
(5)流程中获得七水硫酸锌前省略的操作是______________、冷却结晶、过滤、洗涤和低温烘干;
(6)除铁过程中,反应温度、溶液pH对除铁效果均有影响,为探究除铁的最佳效果,某同学做了以下的实验并记录了相关数据,请回答问题:
编号 | 反应温度/℃ | 溶液pH | 除铁率/% |
a | 30 | 2 | 91.5 |
b | 30 | 2.5 | 93.3 |
c | 40 | 2.5 | 95.1 |
d | 40 | 3.1 | Y |
e | 50 | 3.1 | 99.5 |
①实验____和实验_____对比,得到的结论为其他条件不变时,反应温度增大,除铁率提高;
②实验a和实验b对比,得到结论是____________;
③表中Y的值可能为_____________(填编号)
A 93.4 B 94.1 C 97.8 D 99.6
④最佳的除铁条件为反应温度______℃,溶液pH_________。
【题目】纯碱产品中常含有少量的氯化钠杂质,在实验室中取50g纯碱样品,平均分成五份依次加入到盛有100g稀盐酸的锥形瓶中(锥形瓶的质量为30g),每次充分反应后都进行称量,得到的实验数据如表:
第一次 | 第二次 | 第三次 | 第四次 | 第五次 | |
加入纯碱样品的质量/g | 10 | 10 | 10 | 10 | 10 |
电子天平的示数/g | 137.8 | a | 153.4 | 161.2 | 171.2 |
(1)a的值为_____。
(2)计算纯碱样品中碳酸钠的质量_____。
(3)计算所用稀盐酸的溶质质量分数_____。