题目内容
(7分)工业上采用离子交换膜电解槽电解饱和食盐水,可以得到高浓度的烧碱溶液(含NaOH35%~48%)。某学习小组为了验证附近氯碱化工厂产生的NaOH溶液是否达到高浓度标准,进行了如下操作,请你参与计算:
(1)到工厂采集了电解槽中的NaOH溶液100g。NaOH中氧元素的质量分数 是 。
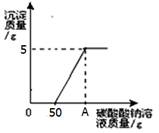
(2)在实验室用如图所示浓硫酸配制200g24.5%的稀硫酸,计算所取浓硫酸的体积(计算结果取整数)。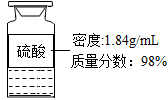
(3)进行中和测定,向采集到的溶液中逐滴加入所配制的稀硫酸,并不断测定溶液的pH值,当pH=7时,消耗稀硫酸160g。通过计算判断此时电解槽中NaOH溶液是否达到高浓度标准。
(1)40%(2)需要浓硫酸的体积为200g×24.5%÷98%÷1.84g/ml≈27ml
(3设参加反应的氢氧化钠的质量分数为X
H2SO4 + 2NaOH==Na2SO4+2H2O
98 80
160g×24.5% 100gX
98:80=160g×24.5%:100gX
X=32%
32%<35% 所以该溶液没有达到高浓度标准
解析试题分析:(1)根据氢氧化钠的化学式,可计算其中所含氧元素的质量分数为: ×100%=40%
×100%=40%
(2)稀释浓硫酸时,其中的溶质的质量不变。具体解题过程为:
需要浓硫酸的体积为200g×24.5%÷98%÷1.84g/ml≈27ml
(3)根据题意可知:反应为硫酸与氢氧化钠反应生成硫酸钠和水。已知量为硫酸的质量,未知量为氢氧化钠溶液的溶质质量分数。解题思路:可根据化学方程式中氢氧化钠与硫酸的质量关系,先求出反应的氢氧化钠的质量。然后再根据溶质质量分数计算的方法,求出氢氧化钠溶液的溶质质量分数,即可判断具体解题过程如下:
解:(1)氢氧化钠中所含氧元素的质量分数为: ×100%=40%
×100%=40%
(2)需要浓硫酸的体积为200g×24.5%÷98%÷1.84g/ml≈27ml
(3设参加反应的氢氧化钠的质量分数为X
H2SO4 + 2NaOH==Na2SO4+2H2O
98 80
160g×24.5% 100gX
98:80=160g×24.5%:100gX
X=32%
32%<35% 所以该溶液没有达到高浓度标准
答:(1)氢氧化钠中氧元素的质量分数为40%。
(2)需要浓硫酸的体积为27ml
(3)电解槽中NaOH溶液没有达到高浓度标准。
考点:根据化学方程式的计算

将17.4g部分变质的氢氧化钙,加入到200g7.3%的稀盐酸中,恰好完全反应,则所得溶液中溶质的质量为
| A.11.1g | B.14.2g | C.22.2g | D.44.4g |
化学兴趣小组在化学实验室发现了一瓶已部分变质的氢氧化钠溶液,想测试它的变质情况。小组同学取10g该溶液放入烧杯中,然后将20g稀盐酸分4次加入同一个烧杯中充分反应,反应后称量质量。
变质的 分四次 每次反应后
NaOH溶液 加入稀盐酸 称量质量
实验过程的数据记录如下:
| 实验序号 | 1 | 2 | 3 | 4 |
| 稀盐酸的质量(g) | 5 | 5 | 5 | 5 |
| 反应后烧杯内物质的质量 | 15 | 19.56 | 24.12 | 29.12 |
(1)写出第四次实验后溶液中溶质的化学式____________;
(2)写出第二次实验中反应的化学方程式___________________________________;
(3)根据已知条件,列出求解参加反应的碳酸钠质量(x)的比例式_____________;
(4)所用稀盐酸的溶质质量分数为___________;
(5)该氢氧化钠溶液中变质的氢氧化钠与剩余氢氧化钠的质量比为______________;
(6)第三次反应后的溶液中,再加入5.88g水,所得溶液中溶质的质量分数为_____。