题目内容
【题目】锌锰干电池由锌皮和炭包构成,其中炭包的主要成分为 ZnCl2、NH4Cl、MnO2、炭粉 (含少量 Cu、Ag、Fe)。由废旧电池炭包制备纯 MnO2的工艺如下:
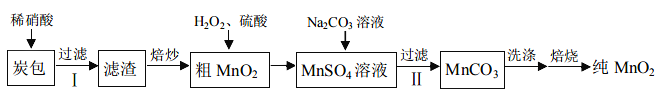
已知:稀硝酸能与 Cu、Ag、Fe 反应,不与 MnO2反应。
(1)炭包中需加入过量的稀硝酸,目的是________。
(2)通过“焙炒”除去滤渣中的炭粉,反应的化学方程式为_______。该工序中需要将滤渣不断搅动翻炒,目的是_________。
(3)过滤Ⅱ后洗涤滤渣,证明滤渣已洗净的方法是:______,则已洗净。
(4)“焙烧”时![]()
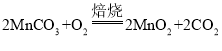 ,过程中发生氧化反应的物质是___。
,过程中发生氧化反应的物质是___。
【答案】将金属除尽 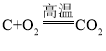 使滤渣均匀受热,保证炭粉能与O2充分接触而反应除去 取最后一次洗涤液,加入硝酸钡溶液,若无白色沉淀 MnCO3
使滤渣均匀受热,保证炭粉能与O2充分接触而反应除去 取最后一次洗涤液,加入硝酸钡溶液,若无白色沉淀 MnCO3
【解析】
(1)由题意炭包的主要成分为 ZnCl2、NH4Cl、MnO2、炭粉,还含有少量 Cu、Ag、Fe,根据流程图和题干信息,炭包中加入过量的稀硝酸,目的是反应掉碳包中的金属Cu、Ag、Fe,将金属除尽。
(2)由流程图可知滤渣的主要成分是炭粉和MnO2,通过“焙炒”除去滤渣中的炭粉,炭粉与空气中的氧气在高温条件下会反应生成二氧化碳,反应的化学方程式为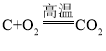 。该工序中需要将滤渣不断搅动翻炒,可以使炭粉与O2充分接触,滤渣均匀受热,使炭粉充分反应除去。
。该工序中需要将滤渣不断搅动翻炒,可以使炭粉与O2充分接触,滤渣均匀受热,使炭粉充分反应除去。
(3)由流程图可知,加入碳酸钠溶液与硫酸锰反应生成碳酸锰沉淀和硫酸钠,过滤Ⅱ后洗涤滤渣,要证明滤渣已洗净,只需要验证最后一次洗涤液中是否含有硫酸根即可,可以利用可溶性钡离子的盐溶液来进行验证,因此证明滤渣已洗净的方法是,取最后一次洗涤液,加入硝酸钡溶液,若无白色沉淀,则已洗净。
(4)物质与氧气的反应属于氧化反应,由题意结合“焙烧”反应的方程式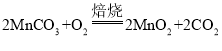 可知,该过程中发生氧化反应的物质是MnCO3。
可知,该过程中发生氧化反应的物质是MnCO3。

 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案【题目】某校化学兴趣小组的同学在实验室整理化学药品时,发现一瓶金属铬。为了解铬与常见金属铝、铜在金属活动性顺序中的相对位置关系,他们进行了如下探究活动。
[查阅资料]铬(Cr)是银白色金属,在空气中表面能形成致密的氧化膜
[提出假设]考虑到铝的活动性比铜强,提出了三种假设:
假设①:A1>Cr>Cu
假设②:______。
假设③:____。
[实验过程]取大小相同的Cr、Cu、Al三种金属薄片,用砂纸打磨光亮后,分别放入三支试管中,再分别加入等体积20%的稀硫酸。
[实验现象]
金属 | Cr | Cu | Al |
实验现象 | 铬片表面产生气泡缓慢 | 铜表面无明显变化 | 铝表面产生 气泡较快 |
[实验结论]假设____成立(填序号)。
[问题与反思]
(1)由上述结论可知:铬可以与硫酸铜溶液发生反应。请写出该反应的化学方程式:____(已知在该反应的生成物中铬元素显+2价)。
(2)小丽提出,按上述实验操作,用硫酸铜溶液代替稀硫酸也能得出三种金属的活动性顺序,你认为____(填“可行 ”或“不可行”),理由是____。
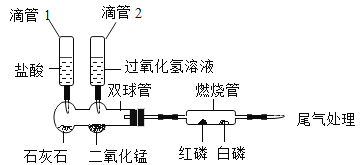
【题目】实验小组同学验证Ca(OH)2溶液导电性的实验装置如图1所示。实验观察到灯泡变亮的同时,两个电极上均有气体产生,且阳极附近出现了白色浑浊。小组同学对白色浑浊物的成分进行了如下探究。
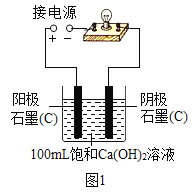
(猜想一)甲同学认为:白色浑浊物是Ca(OH)2。
(实验一)为了验证甲同学的猜想,进行如下实验。取少量白色浊液于试管中,加入足量水,充分振荡,观察到仍有白色浑浊。
(猜想二)乙同学认为:白色浑浊物中含有CaCO3。
(实验二)为了验证乙同学的猜想,进行如下实验。取少量白色浊液于试管中,滴加稀盐酸,白色浑浊消失,没有观察到有气泡产生。
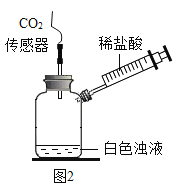
(实验三)为了进一步验证乙同学的猜想,进行如下实验。
实验装置图 | 实验操作 | 实验现象 |
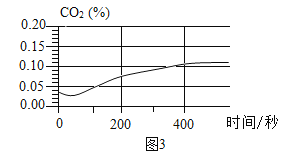
| 将注射器内稀盐酸推入瓶中,并用二氧化碳传感器测得装置内二氧化碳的体积分数 | I.白色浑浊消失,没有观察到有气泡产生 II.检测到二氧化碳含量随时间的变化如下图所示
|
(解释与结论)
(1)用石墨电极验证Ca(OH)2溶液的导电性实验时,两个电极上产生大量气体,发生的是电解水的反应,写出反应的化学方程式________。
(2)甲同学提出白色浑浊为Ca(OH)2的理由是_____。
(3)由实验三得出的结论是____,相关反应的化学方程式为____。
(反思与交流)
(4)实验二中没有观察到明显气泡的可能原因是____。
(5)丙同学为了进一步探究白色浑浊物产生的原因,用铂(Pt)电极代替石墨(C)电极完成图1所示实验,其目的是________。