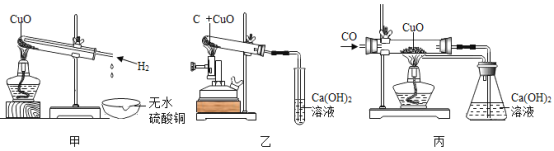
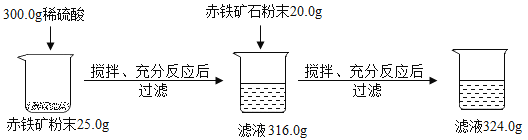
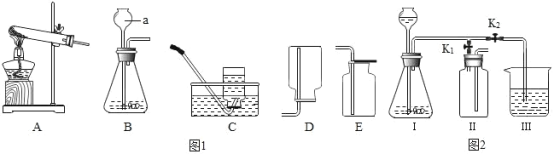
题目内容
【题目】某研究小组为探究“铁丝和盐酸反应的快慢与什么因素有关”,取相同质量的铁丝和足量的盐酸反应得到下表中的三组实验数据,请回答下列问题:
实验编号 | 盐酸的质量分数/% | 反应温度/°C | 铁丝消失的时间/s |
① | 3 | 20 | 300 |
② | 6 | 20 | 200 |
③ | 6 | 40 | 40 |
(1)写出铁丝和盐酸反应的化学方程式:________________。
(2)实验②和③可探究________对铁丝和盐酸反应快慢的影响。若欲探究浓度对铁丝和盐酸反应快慢的影响,应选择的实验编号是____________。
(3)根据上表中的实验数据,可得出的结论是_______(写出一点即可)。
(4)如果把上表中实验②的反应温度改为25°C,请推测铁丝消失的时间t的取值范围:__________。
(5)实验除了用铁丝消失的时间来衡量反应的快慢外,你还能提出新的方法来衡量该反应的快慢吗?你的方法有________(写一点即可)。
【答案】![]() 温度 ①② 盐酸的质量分数越大,反应速率越快(或反应温度越高,反应速率越快) 40s<t<200s 用排水法收集一瓶氢气所需时间的多少来衡量或通过单位时间内生成氢气的量来衡量等
温度 ①② 盐酸的质量分数越大,反应速率越快(或反应温度越高,反应速率越快) 40s<t<200s 用排水法收集一瓶氢气所需时间的多少来衡量或通过单位时间内生成氢气的量来衡量等
【解析】
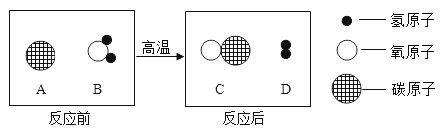
(1)铁和稀盐酸反应生成氯化亚铁和氢气,反应的方程式为:![]() 。故填:
。故填:![]() ;
;
(2)通过实验中②和③对比,盐酸的浓度相同,而反应的温度不同,温度越高,反应越快;要比较不同浓度对反应快慢的影响,应为浓度不同,而其他要素完全一致,所以对应的实验编号是①②。故填:温度;①②;
(3)由实验①②可知,盐酸的质量分数越大,反应速率越快,由实验②③可知,反应温度越高,反应速率越快。故填:盐酸的质量分数越大,反应速率越快(或反应温度越高,反应速率越快);
(4)根据表格中数据,盐酸质量分数为6%时,20℃时,铁丝消失的时间为200秒,40℃时,铁丝消失的时间为40秒,又温度越高,反应越快,所以如果实验②反应的温度改为25℃,铁丝消失的时间(用t表示)的取值范围40s<t<200s;故填:40s<t<200s;
(5)实验除了用铁丝消失的时间来衡量反应的快慢外,还可以用排水法收集一瓶氢气所需时间的多少来衡量或通过单位时间内生成氢气的量来衡量等。故填:用排水法收集一瓶氢气所需时间的多少来衡量或通过单位时间内生成氢气的量来衡量等。

 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案【题目】无水氯化镁是制备某种催化剂的中间体。某研究性学习小组设计实验方案进行制取无水氯化镁等实验。请填写下列空白。
(1)[实验一]
利用下图实验装置(夹持和加热装置省略) , 在HCl气流中小心加热MgCl2. 6H2O晶体制取无水氯化镁(无水氯化镁易吸水)。烧瓶中发生的反应为:![]() 。
。
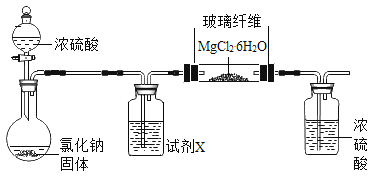
①试剂X是____。第二个洗气瓶中的浓硫酸的作用是_____。
②该实验装置存在一个缺陷是___。
(2)[实验二]
通过下列步骤,测定实验一所得产物中氯元素含量以确定产物是否含有结晶水:
称取m1 g样品置于烧杯中,充分溶解;加入足量硝酸银溶液,充分反应后,过滤;洗涤沉淀,干燥至恒重,称得沉淀质量为m2 g。
①若步骤③的操作中未洗涤沉淀,将导致测得的氯元素含量___ ( 填“偏高”或“偏低”)。
②若测得m1=10.40,m2=28.70,则所得产品MgCl2.nH2O中n的值为___。
(3)[实验三]
一定条件下,氯化镁与四氯化钛的混合物可作烯烃聚合反应的催化剂。为了探究温度、氯化镁固体的含水量以及粉碎方式对该催化剂催化效果的影响,设计如下对比实验:
实验序号 | 氯化镁固体中氯元素含量/% | 温度/°C | 粉碎方式 | 催化效果/g.g-1 |
1 | 70.97 | 20 | 滚动球磨 |
|
2 | 74.45 | 20 | 滚动球磨 |
|
3 | 74.45 | 20 | 振动球磨 |
|
4 | ω | 100 | 振动球磨 |
注:催化效果用单位时间内每克催化剂得到产品的质量来表示
①表中ω=_____。
②从实验1、2可以得出的结论是_______。
③设计实验2、3的目的是___。