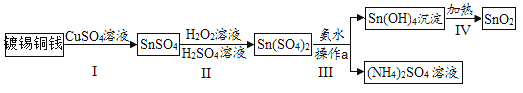
题目内容
【题目】用甲乙丙三套装置进行H、C、CO还原CuO的实验并检验产物(已知白色粉末无水硫酸铜遇水变蓝色)。分析上述三个实验,下列说法错误的是
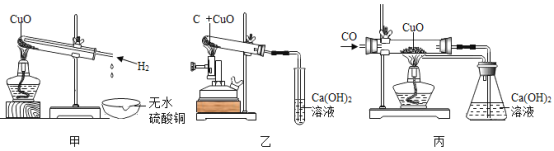
A.甲乙丙三个实验都能观察到黑色粉末变红色的现象,并能成功检验产物
B.甲乙丙三个反应中,反应前后Cu元素的化合价都降低,O元素的化合价都不变
C.甲乙丙三个实验能说明H、C、CO都具有还原性,且三个反应都是置换反应
D.若反应前称量丙中硬质玻璃管及氧化铜的总质量为60g,通入一氧化碳反应一段时间后,冷却称量硬质玻璃管及其中物质的总质量为58.4g,则参加反应的氧化铜的质量为8g
【答案】C
【解析】
A、甲实验中观察到的现象是试管内的固体由黑变红,试管口处的液滴能够使无水硫酸铜变蓝,由观察到的现象可知,反应后生成铜和水,实验乙和丙观察到的现象都是试管或玻璃管内的固体由黑变红,澄清的氢氧化钙溶液变浑浊,由观察到的现象可知,实验乙和丙反应后的生成物都是铜和二氧化碳,选项正确;
B、三个反应中,氧化铜被还原为铜,铜元素的化合价由+2价变为0价,氧元素的化合价在反应前后都为-2价,保持不变,选项正确;
C、实验甲与乙都是一种单质与一种化合物反应生成另一种单质与另一种化合物的反应,属于置换反应,实验丙是两种化合物反应生成一种单质与另一种化合物的反应,不符合置换反应的特征,不属于置换反应,选项错误;
D、由质量守恒定律可知,参加反应的氧化铜中的氧元素的质量为60g58.4g=1.6g,则参加反应的氧化铜的质量为1.6g÷![]() ×100%=8g,选项正确,故选C。
×100%=8g,选项正确,故选C。

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
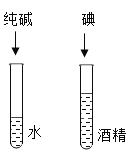
小学教材完全解读系列答案【题目】某研究小组为探究“铁丝和盐酸反应的快慢与什么因素有关”,取相同质量的铁丝和足量的盐酸反应得到下表中的三组实验数据,请回答下列问题:
实验编号 | 盐酸的质量分数/% | 反应温度/°C | 铁丝消失的时间/s |
① | 3 | 20 | 300 |
② | 6 | 20 | 200 |
③ | 6 | 40 | 40 |
(1)写出铁丝和盐酸反应的化学方程式:________________。
(2)实验②和③可探究________对铁丝和盐酸反应快慢的影响。若欲探究浓度对铁丝和盐酸反应快慢的影响,应选择的实验编号是____________。
(3)根据上表中的实验数据,可得出的结论是_______(写出一点即可)。
(4)如果把上表中实验②的反应温度改为25°C,请推测铁丝消失的时间t的取值范围:__________。
(5)实验除了用铁丝消失的时间来衡量反应的快慢外,你还能提出新的方法来衡量该反应的快慢吗?你的方法有________(写一点即可)。
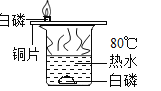
【题目】探究铜生锈的条件
(提出猜想)根据铜锈的组成推测,铜生锈可能与CO2、H2O和O2有关。
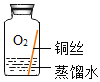
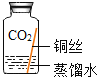
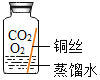
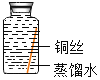
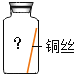
(进行实验)实验小组同学取直径、长度均相同的铜丝,并打磨光亮。设计了如下图所示的5个实验并持续观察。
编号 | ① | ② | ③ | ④ | ⑤ |
实验 |
|
|
|
|
|
现象 | 无明显现象 | 无明显现象 | 铜丝表面有绿色物质 | 无明显现象 | 无明显现象 |
(解释与结论)
(1)实验中使用“经煮沸迅速冷却的蒸馏水”,其目的是_____。
(2)得出“铜生锈一定与O2有关”的结论,依据的两个实验是_____(填编号)。
(3)对比实验①和③,得出的结论是_____。
(4)为验证猜想,实验⑤广口瓶中除铜丝外,还应有的物质是_____。
(5)由上述实验可推知,铜生锈的条件是_____。
(反思与应用)
(6)结合上述实验,你对保存铜制品的建议是_____。
【题目】不同的交通工具使用着不同的材料,根据下列信息回答问题。
交通工具 |
共享单车 |
大飞机C919 |
共享汽车 |
用到的材料 | 轮胎:橡胶 | 机翼:铝锂合金 | 车身:钢 |
(1)上述材料中,含有的金属元素是_____,属于有机合成材料的是_____(写出一种即可)。
(2)大飞机C919大量使用铝锂合金,原因是_____。
(3)铝比铁活泼,为什么错的抗腐蚀性能更好?_____
(4)汽车车身表面的烤漆不仅美观,还能起到防锈的作用,防锈的原理是_____。