题目内容
【题目】某兴趣小组欲测定铁矿石中氧化铁的含量,取一定量的矿石粉碎后,用下图方式进行实验,(注意:杂质既不溶于水也不与酸反应,实验过程中物质的损失忽略不计)
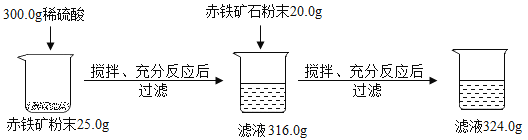
(1)求赤铁矿中氧化铁的质量分数是 。
(2)原300.0g稀硫酸中溶质的质量分数。(写出计算过程,结果保留0. 1%)
【答案】64%;14.7%
【解析】
(1)解:向第一次实验后的316.0g滤液中加入赤铁矿石粉末20.0g,再次过滤,滤液的质量增加了324.0g316.0g=8.0g,第二次加入的赤铁矿石也参加了反应,则第一次反应后稀硫酸有剩余,说明第一次的赤铁矿石粉末25.0g中的氧化铁全部与稀硫酸,25.0g赤铁矿石中的杂质的质量为300.0g+25.0g316.0g=9.0g,赤铁矿中氧化铁的质量分数是![]() ×100%=64%,故填64%。
×100%=64%,故填64%。
(2)解:氧化铁总质量:(20g+25g)×64%=28.8g参加反应的氧化铁的质量为324.0g300.0g=24.0g,300g稀硫酸完全反应。
设参加反应的纯硫酸的质量为x

160:294=24.0g:x
x=44.1g
原300.0g稀硫酸中溶质的质量分数![]() ×100%≈14.7%
×100%≈14.7%
答:原300.0g稀硫酸中溶质的质量分数为14.7%。

【题目】某研究小组为探究“铁丝和盐酸反应的快慢与什么因素有关”,取相同质量的铁丝和足量的盐酸反应得到下表中的三组实验数据,请回答下列问题:
实验编号 | 盐酸的质量分数/% | 反应温度/°C | 铁丝消失的时间/s |
① | 3 | 20 | 300 |
② | 6 | 20 | 200 |
③ | 6 | 40 | 40 |
(1)写出铁丝和盐酸反应的化学方程式:________________。
(2)实验②和③可探究________对铁丝和盐酸反应快慢的影响。若欲探究浓度对铁丝和盐酸反应快慢的影响,应选择的实验编号是____________。
(3)根据上表中的实验数据,可得出的结论是_______(写出一点即可)。
(4)如果把上表中实验②的反应温度改为25°C,请推测铁丝消失的时间t的取值范围:__________。
(5)实验除了用铁丝消失的时间来衡量反应的快慢外,你还能提出新的方法来衡量该反应的快慢吗?你的方法有________(写一点即可)。