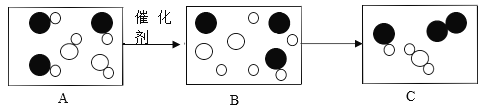
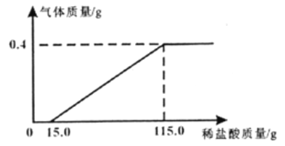
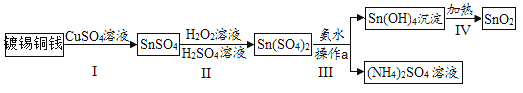
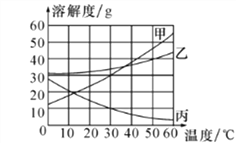
题目内容
【题目】无水氯化镁是制备某种催化剂的中间体。某研究性学习小组设计实验方案进行制取无水氯化镁等实验。请填写下列空白。
(1)[实验一]
利用下图实验装置(夹持和加热装置省略) , 在HCl气流中小心加热MgCl2. 6H2O晶体制取无水氯化镁(无水氯化镁易吸水)。烧瓶中发生的反应为:![]() 。
。
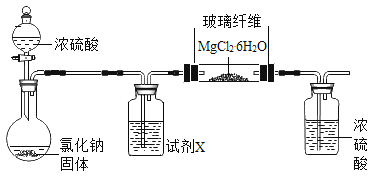
①试剂X是____。第二个洗气瓶中的浓硫酸的作用是_____。
②该实验装置存在一个缺陷是___。
(2)[实验二]
通过下列步骤,测定实验一所得产物中氯元素含量以确定产物是否含有结晶水:
称取m1 g样品置于烧杯中,充分溶解;加入足量硝酸银溶液,充分反应后,过滤;洗涤沉淀,干燥至恒重,称得沉淀质量为m2 g。
①若步骤③的操作中未洗涤沉淀,将导致测得的氯元素含量___ ( 填“偏高”或“偏低”)。
②若测得m1=10.40,m2=28.70,则所得产品MgCl2.nH2O中n的值为___。
(3)[实验三]
一定条件下,氯化镁与四氯化钛的混合物可作烯烃聚合反应的催化剂。为了探究温度、氯化镁固体的含水量以及粉碎方式对该催化剂催化效果的影响,设计如下对比实验:
实验序号 | 氯化镁固体中氯元素含量/% | 温度/°C | 粉碎方式 | 催化效果/g.g-1 |
1 | 70.97 | 20 | 滚动球磨 |
|
2 | 74.45 | 20 | 滚动球磨 |
|
3 | 74.45 | 20 | 振动球磨 |
|
4 | ω | 100 | 振动球磨 |
注:催化效果用单位时间内每克催化剂得到产品的质量来表示
①表中ω=_____。
②从实验1、2可以得出的结论是_______。
③设计实验2、3的目的是___。
【答案】浓H2SO4 吸收空气中的水,防止MgCl2水解 无尾所处理装置, HCl会进入空气,造成污染 偏高 0.5 74.45 其它条件相同时,氯化镁固体氯含量越高,催化效果越好 探究其它条件相同时,粉碎方式对催化效果的影响
【解析】
(1)①烧瓶中发生的反应为:NaCl+H2SO4(浓)=NaHSO4+HCl↑,制得的氯化氢气体中含有水蒸气,氯化镁中的镁离子易水解,需用浓硫酸干燥氯化氢,所以X为浓硫酸。第二个瓶中的浓硫酸可以防止空气中的水进入到玻璃管中,可以防止MgCl2水解。
②氯化氢是污染性气体,故该装置中缺少尾气处理装置。
(2)①若步骤③的操作中未洗涤沉淀,杂质误计入氯化银沉淀,故测量结果偏大。
②m1=10.40是样品质量,m2=28.70是AgCl质量,n(AgCl)=![]() =
=![]() =0.2mol,2n(AgCl)=n(MgCl2),n(MgCl2)=0.1mol,m(MgCl2)=9.5g,则n(H2O)=
=0.2mol,2n(AgCl)=n(MgCl2),n(MgCl2)=0.1mol,m(MgCl2)=9.5g,则n(H2O)=![]()
=0.05mol,n(MgCl2)=0.1mol,则n(MgCl2):n(H2O)=1:0.5
,即n=0.5
(3)①做对比实验时只能改变一个条件,由表中数据可知,实验4中温度为100℃,所以与实验3比较其它条件不变,则ω=74.45,故答案为:74.45;
②实验1中氯元素含量低,则水的含量高,对应的催化效果差,所以氯化镁固体含水量越高,催化剂催化效果越差,故答案为:氯化镁固体含水量越高,催化剂催化效果越差;
③实验2、3中改变的条件中只有粉碎方式不同,其它都相同,所以实验2、3的目的是探究粉碎方式对催化剂催化效果的影响,
故答案为:探究粉碎方式对催化剂催化效果的影响.

【题目】某研究小组为探究“铁丝和盐酸反应的快慢与什么因素有关”,取相同质量的铁丝和足量的盐酸反应得到下表中的三组实验数据,请回答下列问题:
实验编号 | 盐酸的质量分数/% | 反应温度/°C | 铁丝消失的时间/s |
① | 3 | 20 | 300 |
② | 6 | 20 | 200 |
③ | 6 | 40 | 40 |
(1)写出铁丝和盐酸反应的化学方程式:________________。
(2)实验②和③可探究________对铁丝和盐酸反应快慢的影响。若欲探究浓度对铁丝和盐酸反应快慢的影响,应选择的实验编号是____________。
(3)根据上表中的实验数据,可得出的结论是_______(写出一点即可)。
(4)如果把上表中实验②的反应温度改为25°C,请推测铁丝消失的时间t的取值范围:__________。
(5)实验除了用铁丝消失的时间来衡量反应的快慢外,你还能提出新的方法来衡量该反应的快慢吗?你的方法有________(写一点即可)。