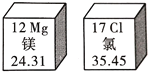
题目内容
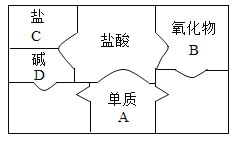
【题目】木炭粉还原氧化铜实验后的混合粉末中含有铜、氧化铜、少量木炭粉,实验室从该混合粉末中回收铜的方法如下:
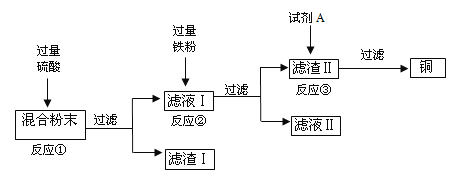
(1)试剂A的名称是______,反应③的化学方程式是______。
(2)过滤是混合物分离的常用方法,过滤后滤液仍然浑浊的可能原因是______,其中玻璃棒的作用是______,上述反应①②③中不属于置换反应的是______。
(3)加入过量的硫酸目的是______。
【答案】稀盐酸(或稀硫酸溶液) Fe+2HCl=FeCl+H↑(或Fe+CuSO=FeSO+Cu) 滤纸破损(或仪器不干净、滤液高于滤纸边缘等) 引流 ① 使氧化铜完全反应
【解析】
在铜、氧化铜、少量木炭粉混合物中加入稀硫酸,稀硫酸只和氧化铜反应,故反应①为稀硫酸和氧化铜反应生成硫酸铜和水,过滤后滤渣Ⅰ为铜单质和少量木炭粉,滤液为硫酸铜溶液;反应②为铁单质和硫酸铜反应生成硫酸亚铁和铜,由于铁粉过量,过滤后滤液Ⅱ为硫酸亚铁,滤渣Ⅱ为铁和铜;反应③为将铜单质中的杂质铁除去,除去铁可以用稀盐酸或稀硫酸(不可以用硫酸铜等,因为生成的铜附着在铁的表面导致无法彻底反应,导致得到的铜不纯),所以试剂A的名称是稀盐酸或稀硫酸,过滤后得到铜单质。
(1)根据分析可知试剂A的名称是稀盐酸或稀硫酸,(不可以用硫酸铜等,因为生成的铜附着在铁的表面导致无法彻底反应,导致得到的铜不纯),反应③的化学方程式是 Fe+2HCl=FeCl+H↑或者Fe+H2SO4=FeSO4+H2↑。
(2)过滤后滤液仍然浑浊的原因可能是滤纸破损(或仪器不干净、滤液高于滤纸边缘等),玻璃棒的作用是引流,反应①CuO+H2SO4=CuSO4+H2O,为复分解反应;②Fe+CuSO4=FeSO4+Cu,为置换反应;③是Fe+2HCl=FeCl+H↑或者Fe+H2SO4=FeSO4+H2↑,为置换反应。所以①不属于置换反应。
(3)加入过量的硫酸目的是让氧化铜完全反应。

【题目】小花同学发现自己的铜制眼镜框表面出现了绿色的铜锈。为了弄清铜绿的组成和铜生锈生成铜绿的条件,小花与她们的化学实验小组进行了如下探究实验:
(一)探究铜绿的组成。
(查阅资料)“铜锈”主要成分是Cu2(OH)2CO3(俗称铜绿);铜绿受热易分解。
(实验设计)
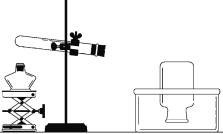
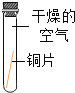
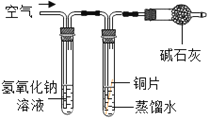
①小花同学从铜制眼镜框上取下适量的干燥铜绿,按图所示装置进行实验。在实验过程中,观察到:试管口有水珠出现,说明了铜绿中含有_________元素;澄清石灰水变浑浊,说明了铜绿中含有________元素。
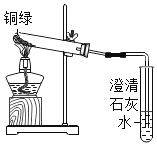
②小阳取下少量试管内反应后的剩余物,放人另一支试管中,滴入稀硫酸,充分反应后,溶液变蓝色,说明铜绿中含有___________元素。
(实验结论)③______________________________________________________________________________。
(二)探究铜生锈的条件。
(查阅资料)1铜绿受热会分解成三种氧化物。
①写出铜绿分解的化学方程式为_______________________________________________________________。
2碱石灰主要成分是氢氧化钠和氧化钙固体的混合物,实验室常用氢氧化钠溶液吸收二氧化碳气体、常用碱石灰除去二氧化碳气体和水蒸气。
(实验设计)借鉴课本“铁钉锈蚀条件的探究”实验,小平设计了“铜片锈蚀条件的探究”实验,实验如下图所示将四小块铜片分别按下图所示放置一个月,观察现象如下:
实验装置 |
|
|
|
|
实验现象 | 铜片不生锈 | 铜片不生锈 | 铜片不生锈 | 铜片生锈且水面附近锈蚀最严重的 |
(实验结论)②铜生锈是铜与氧气、___________、__________等物质共同作用的结果。
(反思应用)③写出防止铁或铜等金属制品生锈的两种不同原理的方法__________________________________________________________________________________________________。