题目内容
【题目】小花同学发现自己的铜制眼镜框表面出现了绿色的铜锈。为了弄清铜绿的组成和铜生锈生成铜绿的条件,小花与她们的化学实验小组进行了如下探究实验:
(一)探究铜绿的组成。
(查阅资料)“铜锈”主要成分是Cu2(OH)2CO3(俗称铜绿);铜绿受热易分解。
(实验设计)
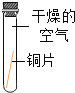
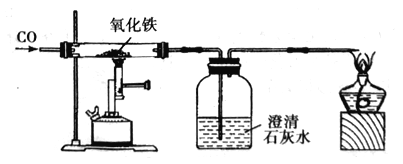
①小花同学从铜制眼镜框上取下适量的干燥铜绿,按图所示装置进行实验。在实验过程中,观察到:试管口有水珠出现,说明了铜绿中含有_________元素;澄清石灰水变浑浊,说明了铜绿中含有________元素。
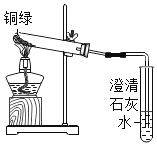
②小阳取下少量试管内反应后的剩余物,放人另一支试管中,滴入稀硫酸,充分反应后,溶液变蓝色,说明铜绿中含有___________元素。
(实验结论)③______________________________________________________________________________。
(二)探究铜生锈的条件。
(查阅资料)1铜绿受热会分解成三种氧化物。
①写出铜绿分解的化学方程式为_______________________________________________________________。
2碱石灰主要成分是氢氧化钠和氧化钙固体的混合物,实验室常用氢氧化钠溶液吸收二氧化碳气体、常用碱石灰除去二氧化碳气体和水蒸气。
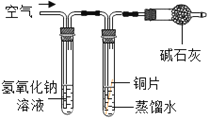
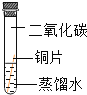
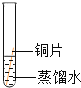
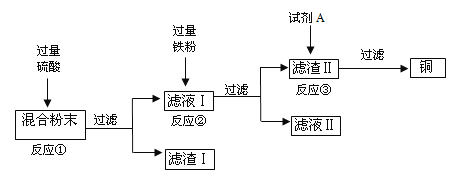
(实验设计)借鉴课本“铁钉锈蚀条件的探究”实验,小平设计了“铜片锈蚀条件的探究”实验,实验如下图所示将四小块铜片分别按下图所示放置一个月,观察现象如下:
实验装置 |
|
|
|
|
实验现象 | 铜片不生锈 | 铜片不生锈 | 铜片不生锈 | 铜片生锈且水面附近锈蚀最严重的 |
(实验结论)②铜生锈是铜与氧气、___________、__________等物质共同作用的结果。
(反思应用)③写出防止铁或铜等金属制品生锈的两种不同原理的方法__________________________________________________________________________________________________。
【答案】氢元素和氧元素 碳元素 铜元素 氢元素、氧元素、铜元素、碳元素 Cu2(OH)2CO3![]() 2CuO+ CO2↑+ H2O; 二氧化碳 水 如刷漆、保持干燥、制成合金
2CuO+ CO2↑+ H2O; 二氧化碳 水 如刷漆、保持干燥、制成合金
【解析】
(一)①据质量守恒定律可知,反应前后元素的种类不变,按右图所示装置进行实验。在实验过程中,观察到:试管口有水珠出现,说明了铜绿中含有氢元素和氧元素;澄清石灰水变浑浊,证明生成二氧化碳,说明了铜绿中含有碳元素;
②含有铜离子的溶液为蓝色,取下少量试管内反应后的剩余物,放入另一支试管中,滴入稀硫酸,充分反应后,溶液变蓝色,说明铜绿中含有铜元素。
③铜绿的组成元素为:氢元素和氧元素、铜元素、碳元素;
(二)①铜绿分解生成二氧化碳、氧化铜、水,化学方程式为Cu2(OH)2CO3![]() 2CuO+ CO2↑+ H2O;
2CuO+ CO2↑+ H2O;
②由第一个实验可知没有水时,铜片不生锈,说明铜生锈需要水;由第二个实验可知,没有二氧化碳时,铜不生锈,说明铜生锈需要二氧化碳;第三实验:没有氧气时铜片不生锈,说明铜生锈需要氧气;第四个实验时,铜同时接触到水、氧气、二氧化碳时生锈了,说明铜生锈是铜与氧气、二氧化碳、水等物质共同作用的结果;
③铁生锈是铁与氧气、水充分接触,防止铁或铜等金属制品生锈的两种不同原理的方法:覆盖保护层(如刷漆),使金属与水、氧气等隔绝;保持干燥;制成合金,提高金属的防锈能力。

【题目】某兴趣小组对食用纯碱和食用小苏打两种粉末进行以下探究.
[查阅资料]
名称 | 食用纯碱 | 食用小苏打 |
主要成分 | Na2CO3 | NaHCO3 |
酸碱性 | 水溶液显碱性 | 水溶液显碱性 |
热稳定性 | 受热不分解 | 270℃时完全分解为碳酸钠、二氧化碳、水 |
[实验探究]
(1)探究两者水溶液酸碱性的差异
小明分别向等浓度的两种溶液中滴入酚酞试液,发现两者都变_____色,但食用纯碱溶液中颜色更深,由此推测可能_____溶液碱性更强.小欢认为要比较两种溶液的碱性强弱,可直接用_____进行测定.
(2)验证两种粉末的稳定性
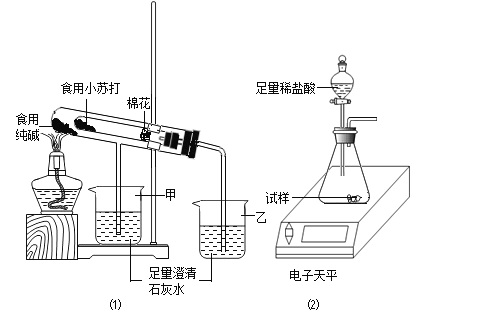
在老师的指导下,该小组按如图1装置进行实验操作,观察到_____(填“甲”或“乙”)烧杯中澄清石灰水变浑浊,试管中发生反应的化学方程式为_____,装置中棉花的作用是_____.
(3)测定食用纯碱粉末的纯度
取食用纯碱粉末试样,利用如图2装置进行实验测定.
数据记录如下:
称量项目 | 称量时间 | 质量/g |
试样 | 11.0 | |
装置+稀盐酸 | 160.0 | |
装置+稀盐酸+试样 | 反应开始后20s | 167.0 |
装置+稀盐酸+试样 | 反应开始后30s | 166.6 |
装置+稀盐酸+试样 | 反应开始后90s | 166.6 |
①反应生成CO2的质量为_____g.
②通过计算确定食用纯碱粉末中Na2CO3的质量分数____.(写出计算过程,结果保留一位小数.)
③如果测得的结果比实际纯度高,可能的原因是_____.(答一种即可)