题目内容
【题目】化学是一门自然科学,其特征是研究物质和创造物质。
(1)硅是太阳能电池和电脑芯片不可缺少的材料。人们利用石英砂(主要成分是二氧化硅)制得高纯硅。生产高纯硅的流程示意图如下:
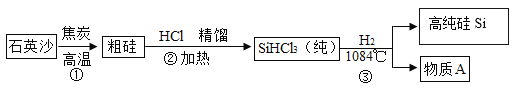
①制备粗硅的反应为: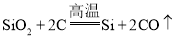 ,该反应属于___反应(选填“分解”“化合”“置换”“复分解”之一)。
,该反应属于___反应(选填“分解”“化合”“置换”“复分解”之一)。
②制备过程中用到H2,在点燃或加热H2前,应该先进行的安全操作是_____。
③物质A通常状况下为无色有刺激性气味的气体,溶于水形成一种常见的酸,写出步骤③中的化学反应方程式_______。
(2)海洋是生命的摇篮,海水不仅是宝贵的水资源,而且蕴藏着丰富的化学资源。加强对海水资源的开发利用,是解决我国沿海和西部苦咸水地区淡水危机和资源短缺问题的重要措施,是实现国民经济可持续发展战略的重要保证。从海水中取得淡水的过程称为“海水淡化”。现在所用的海水淡化方法主要分为蒸馏法(热法)和膜法两大类。
如图所示,对淡化膜右侧的海水加压,水分子可以透过淡化膜进入左侧淡水池,而海水中有些溶质离子不能通过淡化膜,从而得到淡水。
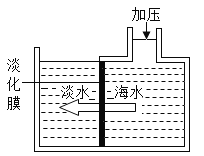
①将少量加压后的右侧海水置于表面皿中,用酒精灯加热,水分蒸干后,可在表面皿上观察到的现象是_______。
②下列对加压后右侧海水成分变化情况的分析中,正确的是___(填选项)。
A 溶质质量增加
B 溶剂质量减少
C 溶液质量不变
D 溶质质量分数减小
③氨碱法制纯碱是先通过化学反应生成NaHCO3和NH4C1,NaHCO3结晶析出,再加热NaHCO3,制得纯碱。根据NaHCO3和NH4C1的溶解度曲线回答下列问题:
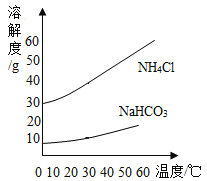
a.40℃时,NH4Cl饱和溶液的溶质质量分数_____NaHCO3饱和溶液的溶质质量分数(选填“大于”“小于”“等于”之一)。
b.把30℃时NH4Cl的饱和溶液升温到50℃后所得溶液是此温度下NH4Cl的溶液___(选填“饱和”或“不饱和”之一)
c.20℃时,将30 gNaHCO3固体置于100g水中,形成的溶液是此温度下NaHCO3的____溶液(选填“饱和”或“不饱和”之一)。
d.在50℃时将等质量的NaHCO3和NH4Cl饱和溶液同时降温到20℃,_____析出晶体质量较多(填化学式)。
【答案】置换 验纯 SiHCl3+H2![]() Si+3HCl 出现固体 B 大于 不饱和 饱和 NH4Cl
Si+3HCl 出现固体 B 大于 不饱和 饱和 NH4Cl
【解析】
(1)①制备粗硅的反应为: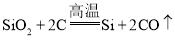 ,是单质和化合物反应生成新的单质和新的化合物,符合置换反应特征,属于置换反应;
,是单质和化合物反应生成新的单质和新的化合物,符合置换反应特征,属于置换反应;
②整个制备过程必须达到无水无氧,若在H2还原SiHCl3过程中混入O2,因为氢气不纯,可能爆炸,在点燃或加热H2前,应该先进行验纯;
③物质A通常状况下为无色有刺激性气味的气体,溶于水形成一种常见的酸,所以③是SiHCl3和氢气在1084℃时生成硅和盐酸,对应的化学反应方程式SiHCl3+H2![]() Si+3HCl;
Si+3HCl;
(2)①海水中含有盐类物质,将少量加压后的右侧海水置于表面皿中,用酒精灯加热,水分蒸干后,可在表面皿上出现固体;
②海水中溶剂是水,由水分子可以透过淡化膜进入左侧淡水池,而海水中的各种离子不能透过淡化膜说明加压后右侧海水中溶剂减少,溶质不变,所以溶液质量也减少,由于溶质不变,所以溶质质量分数增大;
③a.由溶解度曲线可知,40℃时,NH4Cl的溶解度大于NaHCO3的溶解度,由饱和溶液中溶质的质量分数=![]() ×100%,溶解度越大,则该温度下的饱和溶液中溶质的质量分数越大;
×100%,溶解度越大,则该温度下的饱和溶液中溶质的质量分数越大;
b.由溶解度曲线可知,NH4Cl的溶解度随着温度的升高而增大,所以把30℃时NH4Cl的饱和溶液升温到50℃后所得溶液是不饱和溶液;
c.由溶解度曲线可知,20℃时,NaHCO3的溶解度小于30g,所以将30 gNaHCO3固体置于100g水中,固体不能完全溶解,故形成的溶液是此温度下 NaHCO3的饱和溶液;
d.由溶解度曲线可知,NH4Cl的溶解度受温度的影响比NaHCO3大,所以在50℃时将等质量的NaHCO3和NH4C1饱和溶液同时降温到20℃,NH4Cl析出晶体质量较多。