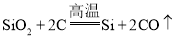��Ŀ����
����Ŀ��̼�����һ�ֳ��õIJ��Ƽ����������оͺ���̼��ơ�Ϊ�ⶨ��������̼��Ƶĺ�������ѧ��ѧ������ѧ���úû�ѧ��ѧϰС���ͬѧ��ȡ20g������鼦���Ƿ����ձ��У��������м���80gϡ����ǡ����ȫ��Ӧ��ע�������в�����Ԫ�أ�Ҳ�������ᷴӦ��ʵ����̲����Ķ�����̼ȫ���ݳ�������Ӧ�����е�ͼ������ͼ��ʾ����ش�
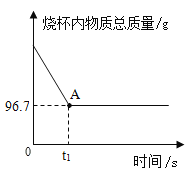
��1�����ڷ�Ӧ������˵��A���ʾ��_____��
��2��ʵ�����������CO2����_____g��
��3����20g�������к�̼��Ƶ���������Ҫ��д��������̣�____
��4����20g�������к���Ԫ�ص���������Ҫ��д��������̣�________
���𰸡��������е�̼���������ǡ����ȫ��Ӧ 3.3 7.5g 3g
��������
��1������A��ʱ���ձ������ʵ����������ڼ��ٷ�����
��2�����������غ㶨�ɷ�����
��3�����ݷ�Ӧ�Ļ�ѧ����ʽ���ɷų�������̼���������㵰��������̼��Ƶ�������
��4�����ݻ�������ijԪ�ص�����=�û��������������Ԫ�ص��������������з������
��1����ͼ��֪��A��ʱ���ձ������ʵ����������ڼ��٣�˵����Ӧǡ��ֹͣ������������е�̼���������ǡ����ȫ��Ӧ��
��2�����������غ㶨��ʵ����������ɶ�����̼������Ϊ�ձ������ʼ��ٵ���������20g+80g-96.7g=3.3g�����3.3��
��3���⣺�輦������̼��Ƶ�����Ϊx

![]() �����x=7.5g���ʴ�Ϊ��7.5g��
�����x=7.5g���ʴ�Ϊ��7.5g��
��4����Ԫ�ص�����Ϊ7.5g��![]() ��100%=3g���ʴ�Ϊ��3g��
��100%=3g���ʴ�Ϊ��3g��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�