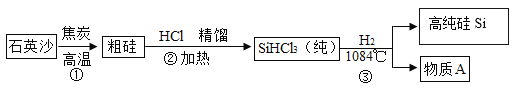
题目内容
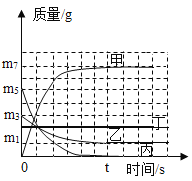
【题目】利用如图所示装置进行如下实验探究。在锥形瓶中放入一小粒白磷,塞好瓶塞后玻璃管下端刚好能与白磷接触,将整套装置放在托盘天平上调节至平衡,取下橡皮塞,将玻璃管放在酒精灯火焰上灼烧至红热,迅速塞紧瓶塞,将白磷引燃,待锥形瓶冷却后观察天平是否平衡。
(1)实验时,气球的变化是_________。
(2)玻璃管受热不燃烧,白磷受热能燃烧,可知燃烧的条件是_________。
(3)实验前后天平保持平衡,实验后,松开橡皮塞,则天平指针_____(填“向左偏”“向右偏”或“指向中间”)
(4)白磷燃烧生成P2O5,写出该反应的化学方程式:__________。
【答案】先变大后变小 物质具有可燃性 向左偏 4P+5O2![]() 2P2O5
2P2O5
【解析】
(1)白磷燃烧释放热量,瓶内气体受热体积膨胀,气球变大,反应后,瓶中气体减少,温度降低,瓶中压强减小,气球又变小,故填先变大后变小。
(2)相同温度下,玻璃管受热不燃烧,白磷受热能燃烧说明玻璃管不具可燃性,白磷具有可燃性,故填物质具有可燃性。
(3)实验时白磷燃烧消耗了氧气,实验后,松开橡皮塞,瓶外气体会进入瓶中,使左盘物质的质量增加,天平指针向左偏转,故填向左偏。
(4)白磷与氧气在点燃的条件下反应生成五氧化二磷,故反应的化学方程式写为:4P+5O2![]() 2P2O5。
2P2O5。

 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案【题目】同学们在学习酸、碱、盐的性质时,进行了如下图所示的实验。
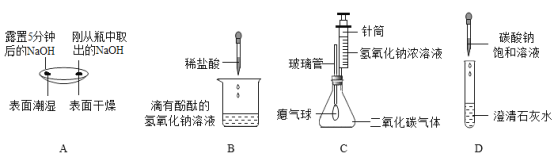
(1)通过分析实验A可知,氢氧化钠会吸收空气中的________。
(2)在实验B发生反应的化学方程式为___。
(3)实验C可观察到的现象是___________。
(4)实验结束后,同学们将A、B、C、D四个实验中的废固和废液同时倒入同一个干净的废液缸中,看到废液浑浊并呈红色。
(提出问题)废液中的哪种物质使酚酞变红?
(提出猜想)使废液中酚酞变红的物质可能是氢氧化钠、氢氧化钙、碳酸钠中的一种或两种。
(查阅资料)I.氯化钙溶液呈中性,Na2CO3溶液和NaHCO3溶液都呈碱性。
II. 在Na2CO3溶液中滴加少量稀盐酸,先发生反应![]() ,继续滴加稀盐酸,再发生
,继续滴加稀盐酸,再发生![]() 。
。
(设计实验)
实验内容 | 实验现象 | 实验结论 |
①取样于试管中,逐滴滴入稀盐酸 | 开始没有气泡,一段时间后产生气泡 | 废液中一定含有碳酸钠, 一定没有________。 |
② 另取样于试管中,先滴加足量CaCl2溶液。 | _____。 | 废液中一定含有氢氧化钠 |
(实验反思)除了上述猜想中的物质外,你认为废液中还可能存在__使废液中的酚酞变红。
(实验拓展)若将上述四个实验中废固和废液倒入另一干净的废液缸中,看到废液澄清并呈无色,则废液中一定含有的阳离子是____。