题目内容
【题目】水是人类宝贵的自然资源
(1)为迎接今年9月在天津举行的全运会,市民们积极为“美丽天津,绿色全运”做贡献.琳琳同学对海河的水样进行了相关研究.
①可以采用_____来测定海河水的酸碱度.
②自制简易净水器净化海河水,其中活性炭起到_____和过滤的作用.
③日常生活中为了降低水的硬度,常采用的方法是_____.
(2)二氧化氯(ClO2)可用作自来水的消毒剂,工业上用氯酸钠(NaClO4)和盐酸反应制取二氧化氯,其反应的化学方程式为:2NaClO3+4HCl═2ClO2↑+Cl2↑+2X+2NaCl.其中X的化学式为____;二氧化氯中氯元素的化合价为_____.
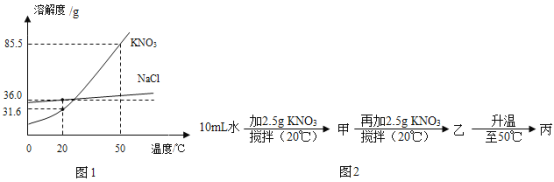
(3)如图为NaCl、KNO3的溶解度曲线(水的密度约为1g/cm3).
①20℃时,KNO3的溶解度是_____.
②茜茜同学利用溶解度曲线进行了图2实验:甲、乙、丙中为饱和溶液的是___(选填“甲”、“乙”或“丙”),甲的溶质的质量分数为___,若将甲溶液稀释到5%,则需加水的质量为___g.
③欲除去KNO3固体中混有的少量NaCl,提纯的方法为_____.
④若将50℃时NaCl、KNO3两种物质的饱和溶液冷却至20℃,该过程中保持不变的是_____(填序号)
A 溶质的质量 B 溶剂的质量 C 溶质的质量分数 D 物质的溶解度
【答案】PH试纸 吸附 煮沸 H2O +4 31.6g 乙 20% 37.5 降温结晶 B
【解析】
(1)①可以采用PH试纸来测定海河水的酸碱度;②根据活性炭有吸附和过滤的作用;③降低水的硬度的方法是:在生活中是加热煮沸,在实验室中是蒸馏;
(2)根据质量守恒定律,等号两边各原子的种类和数目相等分析,根据在二氧化氯中氯元素与氧元素的化合价代数和为零分析;
(3)根据溶解度曲线可知:硝酸钾和氯化钠两种固体物质的溶解度,都是随温度升高而增大,而硝酸钾的溶解度随温度的升高变化比氯化钠大分析;
①观察图像,20℃时,KNO3的溶解度是31.6g;
②根据溶质的质量分数公式计算;
③欲除去KNO3固体中混有的少量NaCl,提纯的方法为降温结晶;
④若将饱和溶液冷却,该过程中保持不变的是溶剂的质量。
(1)根据题目信息可知:可以采用PH试纸来测定海河水的酸碱度,自制简易净水器净化海河水,其中活性炭起到吸附和过滤的作用;降低水的硬度的方法是:在生活中是加热煮沸,在实验室中是蒸馏;故答案为:①PH试纸;②吸附;③煮沸;
(2)根据质量守恒定律,等号两边各原子的种类和数目相等,![]() ,X中有两个H原子和一个O原子;二氧化氯中氯元素的化合价为+4价,因为氧元素的化合价是﹣2价;故答案为:H2O;+4;
,X中有两个H原子和一个O原子;二氧化氯中氯元素的化合价为+4价,因为氧元素的化合价是﹣2价;故答案为:H2O;+4;
(3)20℃时,KNO3的溶解度是31.6g;图2中,甲、乙、丙中为饱和溶液的是乙,并且固体有剩余;水的密度约为1g/cm3,因此水的质量=10mL×1g/mL=10g,甲的溶质的质量分数=![]() =20%;若将甲溶液稀释到5%,则需加水的质量为x,(12.5g+x)×5%=2.5g,x=37.5g;欲除去KNO3固体中混有的少量NaCl,提纯的方法为降温结晶,因为硝酸钾的溶解度受温度的影响比氯化钠大;若将50℃时NaCl、KNO3两种物质的饱和溶液冷却至20℃,该过程中保持不变的是溶剂的质量故答案为:①31.6g;②乙;20%;37.5;③降温结晶;④B;
=20%;若将甲溶液稀释到5%,则需加水的质量为x,(12.5g+x)×5%=2.5g,x=37.5g;欲除去KNO3固体中混有的少量NaCl,提纯的方法为降温结晶,因为硝酸钾的溶解度受温度的影响比氯化钠大;若将50℃时NaCl、KNO3两种物质的饱和溶液冷却至20℃,该过程中保持不变的是溶剂的质量故答案为:①31.6g;②乙;20%;37.5;③降温结晶;④B;