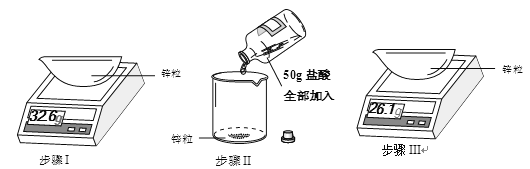
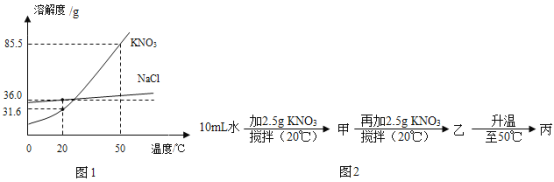
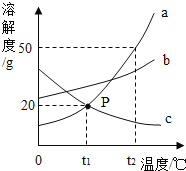
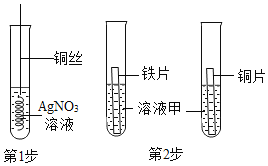
题目内容
【题目】实验室常利用下图部分装置制取氧气。
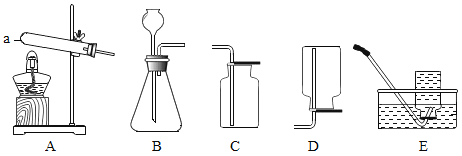
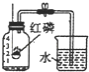
(1)仪器a的名称是_____。
(2)实验室用A装置制备氧气时,反应的化学方程式为_____。
(3)为了获得较干燥的氧气,应选用的收集装置是____(填字母序号)。验满的方法是___。
【答案】试管 2KMnO4![]() K2MnO4 + MnO2 + O2↑ C 将带火星的木条靠近集气瓶口,复燃则氧气已满
K2MnO4 + MnO2 + O2↑ C 将带火星的木条靠近集气瓶口,复燃则氧气已满
【解析】
(1)仪器a是试管。
(2)实验室用A装置制备氧气,试管口放了一团棉花,则是用高锰酸钾制取氧气,反应的化学方程式为2KMnO4![]() K2MnO4 + MnO2 + O2↑。
K2MnO4 + MnO2 + O2↑。
(3)用排水法收集的气体中含有水蒸气,由于氧气的密度比空气的密度大,为了获得较干燥的氧气,应选用的收集装置是C。气体的验满在瓶口处进行,氧气验满的方法为:将带火星的木条靠近集气瓶口,复燃则氧气已满。

 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案【题目】目前使用的燃料大多来自化石燃料。
(1)写出天然气中甲烷完全燃烧的化学方程式______。
(2)分析下表,与煤相比,用天然气作燃料的优点有______。
1g物质完全燃烧 | ||
产生二氧化碳的质量/g | 放出的热量/kJ | |
甲烷 | 2.75 | 56 |
煤碳 | 3.67 | 32 |
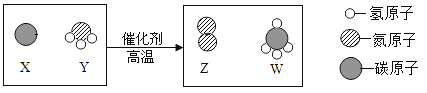
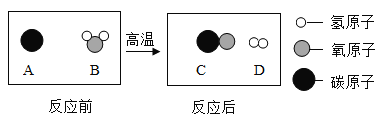
(3)为提高煤的利用率,可将其转化为可燃性气体,该反应的微观示意图如下,则生成物的分子个数比为_____。
【题目】请从A或B两题中任选1个作答,若两题均作答,按A计分。
A | B |
火力发电厂常用石灰石浆吸收废气中的二氧化硫,以防止空气污染。反应化学方程式为: 2CaCO3+O2+2SO2===2CaSO4+2CO2若处理含有1.6 kg二氧化硫的废气,至少需要碳酸钙的质量为________ kg才能将其完全吸收。 | 原煤中含有硫,燃烧时生成的SO2会污染空气。测量SO2含量的化学方程式为:SO2+2H2O+I2=== H2SO4+2HI,取用原煤燃烧产生的工业废气样品1 m3,缓缓通过含碘(I2)1.27 mg的碘溶液,刚好完全反应。则该工业废气中SO2的含量为____mg/m3(假设工业废气中的其它物质不与碘反应)。 |