��Ŀ����
����Ŀ��Ϊ�ⶨij������Ʒ(�������Ȼ��ƺ�13%�IJ��������ʣ����ʲ��μӻ�ѧ��Ӧ)��̼���Ƶĺ�����ȡ50g��Ʒ�����ձ��У�����137.7gˮ����ܽ⣬�����ձ��м���300gϡ���ᣬǡ����ȫ��Ӧ�����ⶨ���ձ������ʵ�������Ϊ474.5g(����������ȫ���ݳ�)����㣺
(1)���ɶ�����̼������_____��
(2)������Ʒ����������_____��
(3)��Ӧ��������Һ��������������_____��
���𰸡�13.2g 63.6% 10%
��������
��1�����������غ㶨�ɣ���ѧ��Ӧǰ�����ʵ����������䣬��̼���ƺ��Ȼ��ƵĹ��������м���ϡ���ᣬֻ��̼���������ᷴӦ����Ӧ�������˶�����̼���岻��������Һ�У�������ö�����̼��������
��2�����ݶ�����̼���������÷���ʽ�������̼���Ƶ���������������̼���Ƶ�����������
��3��Ҫ����Һ�����ʵ�������������Ҫ֪�����ʵ��������������������֣�һ������ԭ�е��Ȼ��ƣ�һ���������ɵ��Ȼ��ơ�
(1)�������غ㶨�ɿ�֪�����ɵĶ�����̼��������50g+137.7g��474.5g=13.2g��
(2)��ԭ����������̼���Ƶ�����Ϊx�������Ȼ��Ƶ�����Ϊy��
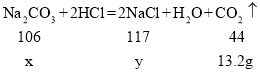
![]()
��ã�x=31.8g y=35.1g
������Ʒ������������![]() =63.6%��
=63.6%��
(3)������Һ�����ʵ���������![]() =10%
=10%
��(1)���ɶ�����̼��������13.2g��(2)������Ʒ������������63.6%��(3)��Ӧ��������Һ����������������10%��

 ̽���빮�̺��Ͽ�ѧ����������ϵ�д�
̽���빮�̺��Ͽ�ѧ����������ϵ�д�����Ŀ��С��ͬѧ����:�������������Ϊ��������(��ѧʽΪCaO2)�Ĺ�������ʱˮ������һЩ����,Ϊ��������������̽����
��������⣩���ѹ�������Ͷ������ˮ��ʱ,���ɵ�������ʲô?
�����в��룩��������������________��
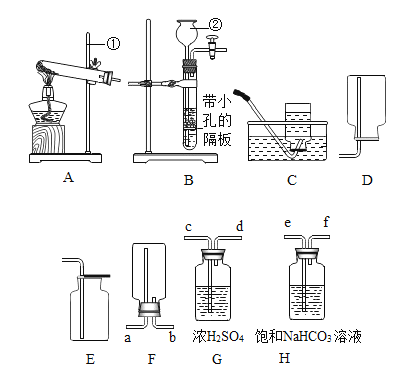
��ʵ��̽����С�������ͼ��ʾ��װ�ý���̽��������װ���з�Һ©���Ļ���,�۲쵽�Թ��������ݲ�������Ӧһ��ʱ���������������������
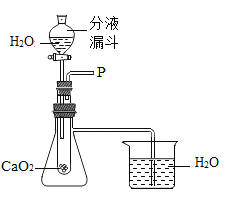
���� | ʵ����� | ʵ������ | ʵ����� |
һ | ��ȼ�ŵ�ľ�����ڵ��ܿ�P�� | û�п�������ȼ�գ���ľ��ȼ�ո���ʢ�� | ����ٴ��� |
�� | �������ǵ�ľ�����ڵ��ܿ�P�� | ____________________�� | �������ȷ |
���������ۣ�
��1��ʵ��ʱ�ձ���Ҳ�����ݳ���,˵���÷�Ӧ����ʱ��________������ȡ������ȡ�����
��2��ͨ��̽��ʵ����Ե�֪�������Ƶ���ȷ���淽����______________��
��3����������������ʱ,������ˮ�м���������������,����ҪĿ����___________��