题目内容
【题目】分析处理图表中的信息是学习化学的一种重要方法.
(1)下表是KNO3、NaCl在不同温度下的溶解度(单位:g/100g水)
温度(℃) | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
KNO3 | 13.3 | 20.9 | 32 | 45.8 | 64 | 85.5 | 110 | 138 | 169 | 202 | 246 |
NaCl | 35.7 | 35.8 | 36 | 36.3 | 36.6 | 37 | 37.3 | 37.8 | 38.4 | 39 | 39.8 |
Ⅰ.20℃时,NaCl的溶解度是 g。
Ⅱ.30℃时,KNO3溶液的最大浓度(溶质质量分数)为 (只列计算式,不需要计算结果).
Ⅲ.KNO3 中含少量氯化钠时,提纯硝酸钾的一般方法是 .
Ⅳ.根据表内数据可知,KNO3和NaCl在某一温度时具有相同的溶解度X,则X的取值范围是 .
(2)如下图是对20℃一定质量的甲的溶液进行恒温蒸发结晶的实验过程,请回答.
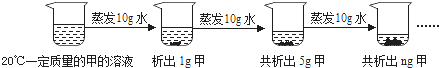
Ⅰ.蒸发前原溶液是 (填“饱和”或“不饱和”)溶液.n的数值是 .
Ⅱ.依据上述实验,你认为甲的溶解度随温度变化的趋势是 (填字母).
A.随温度升高而增大 B.随温度升高而减小 C.无法判断.
【答案】(1)36;45.8g/145.8g ×100%;降温结晶 ;36g< x <36.3g(2)不饱和 ,9,C 。
【解析】
试题分析:(1)Ⅰ.由表格信息可知,20℃时,NaCl的溶解度是36g;
Ⅱ.30℃时,KNO3的溶解度为45.8g,即该温度时,100g水中最多溶解45.8g硝酸钾达到饱和状态,即溶质质量分数最大,溶质的质量分数=45.8g/145.8g ×100% ;
Ⅲ.KNO3 的溶解度受温度的影响变化较大,故提纯硝酸钾的方法是降温结晶;
Ⅳ.根据表内数据可知,KNO3和NaCl在20℃-30℃的溶解度可能相等,溶解度的取值范围是:36g< x <36.3g。
(2)Ⅰ.第二次蒸发10g水后共析出了5g甲,即10g水中能溶解4g甲,而第一次蒸发10g水只析出了1g甲,故原溶液是不饱和溶液;第三次蒸发10g水又会析出4g甲,故共析出甲的质量为9g,即n=9g ;
Ⅱ.由于该实验中没有改变溶液的温度,故不能判断出甲的溶解度与温度的关系。

 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案【题目】写出下列化学反应的表达式及实验现象:
实 验 名 称 | 符 号 表 达 式 | 简 答 |
镁带燃烧 | 生成物中镁元素的存在形态 | |
氢氧化钠溶液中依次滴加酚酞试液和稀盐酸 | 氢氧化钠溶液中滴加无色酚酞试液后试液变 色,再加适量的盐酸后试液变 色 | |
生石灰放入水中 | 块状固体变松散,放出 , 生成物的俗名是 |
【题目】某实验小组想测定黄铜中铜的质量分数,实验数据记录如下:
样品 | 实验1 | 实验2 | 实验3 | 实验4 | 实验5 |
黄铜质量\g | 40 | 40 | 40 | 40 | 40 |
加入稀硫酸质量\g | 30 | 60 | 90 | 120 | 150 |
生成气体质量\g | 0.3 | 0.6 | 0.9 | 1.0 | 1.0 |
(1)根据实验数据分析,从实验 开始金属已经完全反应.
(2)计算黄铜中铜的质量分数.(精确到0.1%)
(3)计算所用稀硫酸的溶质质量分数.(精确到0.1%)