题目内容
【题目】某实验小组想测定黄铜中铜的质量分数,实验数据记录如下:
样品 | 实验1 | 实验2 | 实验3 | 实验4 | 实验5 |
黄铜质量\g | 40 | 40 | 40 | 40 | 40 |
加入稀硫酸质量\g | 30 | 60 | 90 | 120 | 150 |
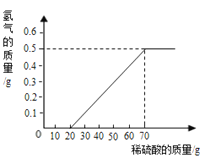
生成气体质量\g | 0.3 | 0.6 | 0.9 | 1.0 | 1.0 |
(1)根据实验数据分析,从实验 开始金属已经完全反应.
(2)计算黄铜中铜的质量分数.(精确到0.1%)
(3)计算所用稀硫酸的溶质质量分数.(精确到0.1%)
【答案】(1)4;(2)黄铜中铜的质量分数为18.8%;
(3)所用稀硫酸的溶质质量分数为49.0%.
【解析】(1)由图表数据可以看出,第4、5次反应生成气体的质量相等,而第4次反应所用稀硫酸质量少,说明第4次实验中金属已经完全反应.
(2)设黄铜中锌的质量为y,
Zn+H2SO4=ZnSO4+H2↑
65 2
y 1.0g
![]()
x=32.5g
黄铜中铜的质量分数为:![]() 100%=18.8%
100%=18.8%
(3)由表中数据可知:第1次反应中稀硫酸完全反应,溶液具有均一性,设稀硫酸的溶质质量为y
Zn+H2SO4=ZnSO4+H2↑
98 2
y 0.3g
![]()
y=14.7g
所用稀硫酸的溶质质量分数=![]() 100%=49.0%
100%=49.0%

【题目】分析处理图表中的信息是学习化学的一种重要方法.
(1)下表是KNO3、NaCl在不同温度下的溶解度(单位:g/100g水)
温度(℃) | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
KNO3 | 13.3 | 20.9 | 32 | 45.8 | 64 | 85.5 | 110 | 138 | 169 | 202 | 246 |
NaCl | 35.7 | 35.8 | 36 | 36.3 | 36.6 | 37 | 37.3 | 37.8 | 38.4 | 39 | 39.8 |
Ⅰ.20℃时,NaCl的溶解度是 g。
Ⅱ.30℃时,KNO3溶液的最大浓度(溶质质量分数)为 (只列计算式,不需要计算结果).
Ⅲ.KNO3 中含少量氯化钠时,提纯硝酸钾的一般方法是 .
Ⅳ.根据表内数据可知,KNO3和NaCl在某一温度时具有相同的溶解度X,则X的取值范围是 .
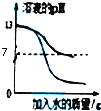
(2)如下图是对20℃一定质量的甲的溶液进行恒温蒸发结晶的实验过程,请回答.

Ⅰ.蒸发前原溶液是 (填“饱和”或“不饱和”)溶液.n的数值是 .
Ⅱ.依据上述实验,你认为甲的溶解度随温度变化的趋势是 (填字母).
A.随温度升高而增大 B.随温度升高而减小 C.无法判断.
【题目】下列四个图象能正确反映实验变化关系的有( )
A | B | C | D |
|
|
|
|
常温下,足量的镁、铁分别同时放入少量等质量、等质量分数的稀盐酸中 | 敞口放置于空气中的浓硫酸或稀盐酸 | 向pH=13的氢氧化钠溶液中不断加水稀释 | 少量的碳在密闭的集气瓶中与氧气完全燃烧 |