题目内容
【题目】分析KNO3、NaCl两种物质的溶解度曲线,回答下列问题。

(1)10℃时,KNO3物质的溶解度是 g;
(2)20℃时,在100g水中溶解25g KNO3物质,得到KNO3溶液的溶质质量分数为 ;
(3)不能用降温的方法使氯化钠结晶,是因为 。
【答案】(1)20;(2)20%;(3)氯化钠的溶解度受温度的影响变化较小
【解析】
试题分析:(1)由溶解度曲线可知,10℃时,KNO3物质的溶解度为20g ;
(2)20℃时,硝酸钾的溶解度为30g,即在100g水中溶解25g KNO3物质,能完全溶解,溶质的质量分数=25g/125g ×100% =20% ;
(3)由于氯化钠的溶解度度受温度的影响变化较小,故只有采用蒸发结晶,而不能采用降温结晶。

 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案【题目】分析处理图表中的信息是学习化学的一种重要方法.
(1)下表是KNO3、NaCl在不同温度下的溶解度(单位:g/100g水)
温度(℃) | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
KNO3 | 13.3 | 20.9 | 32 | 45.8 | 64 | 85.5 | 110 | 138 | 169 | 202 | 246 |
NaCl | 35.7 | 35.8 | 36 | 36.3 | 36.6 | 37 | 37.3 | 37.8 | 38.4 | 39 | 39.8 |
Ⅰ.20℃时,NaCl的溶解度是 g。
Ⅱ.30℃时,KNO3溶液的最大浓度(溶质质量分数)为 (只列计算式,不需要计算结果).
Ⅲ.KNO3 中含少量氯化钠时,提纯硝酸钾的一般方法是 .
Ⅳ.根据表内数据可知,KNO3和NaCl在某一温度时具有相同的溶解度X,则X的取值范围是 .
(2)如下图是对20℃一定质量的甲的溶液进行恒温蒸发结晶的实验过程,请回答.
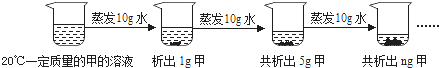
Ⅰ.蒸发前原溶液是 (填“饱和”或“不饱和”)溶液.n的数值是 .
Ⅱ.依据上述实验,你认为甲的溶解度随温度变化的趋势是 (填字母).
A.随温度升高而增大 B.随温度升高而减小 C.无法判断.

