题目内容
【题目】(题文)我国属于海洋大国,浩瀚的海域蕴藏着丰富的化学资源。
(1)海底蕴藏着大量的煤、___________、天然气等常规化石燃料;
(2)天然气的主要成分是甲烷(CH4),可直接用作气体燃料,燃烧反应前后分子种类变化的微观示意图如下所示。
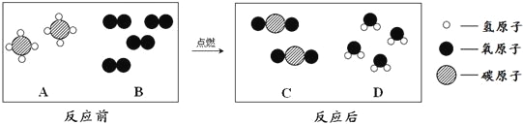
①1个B分子中含有___________个原子;
②四种物质中属于化合物的是__________(填图中字母);
③若8gA参加反应,则生成C的质量为__________g;
(3)海水晒盐能够得到粗盐和卤水,卤水中含有MgCl2、KCl和MgSO4等物质,下图是它们的溶解度曲线。
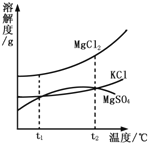
t1℃时,MgCl2、KCl和MgSO4三种物质的饱和溶液中,溶质质量分数最大的是________。将t1℃的MgCl2、KCl和MgSO4三种物质的饱和溶液加热到t2℃以上时,可能会析出__晶体。
【答案】:石油2ACD略略略
【解析】
(1)根据海洋蕴藏的化学资源种类回答.
(2)①根据B的微观结构回答.
②根据化合物的定义和A、B、C、D的微观结构示意图回答.
③根据微观示意图得出反应的化学方程式,然后根据化学方程式中物质间的质量比计算.
(3)根据MgCl2、KCl和MgSO4等物质的溶解度曲线可知,t1℃时,MgCl2、KCl和MgSO4三种物质的溶解度大小,根据饱和溶液中溶质质量分数的计算公式求出质量分数的大小,并进行比较;根据三种物质的溶解度受温度影响的情况,判断其结晶的方法,最后得出结论.
解答:解:(1)瀚的海域蕴藏着丰富的煤、石油、天然气等等常规化石燃料.
(2)①根据B的微观结构示意图,1个B分子中含有2个相同的原子.
②化合物是由不同种元素组成的纯净物,A的分子是由两种原子构成的,即物质是由两种元素组成的,为化合物;B分子由2个相同的原子构成,即是由同种元素组成的,为单质;C分子是由两种原子构成的,即物质是由两种元素组成的,为化合物;D分子是由两种原子构成的,即物质是由两种元素组成的,为化合物.
③根据反应微观示意图知,每2个A分子与4个B分子反应,能生成2个C分子和4个D分子,可以得出甲烷燃烧的化学方程式:CH4+2O2![]() 2H2O+CO2;故A甲烷与C二氧化碳的质量之比为4:11,若8gA参加反应,则生成C的质量为g.
2H2O+CO2;故A甲烷与C二氧化碳的质量之比为4:11,若8gA参加反应,则生成C的质量为g.
(3)根据MgCl2、KCl和MgSO4等物质的溶解度曲线,判断t1℃时,MgCl2、KCl和MgSO4三种物质的溶解度MgCl2最大,饱和溶液中溶质质量分数=![]() ×100%,所以MgCl2的溶质质量分数最大;在MgCl2、KCl和MgSO4三种物质中,从t1℃加热到t2℃以上时,只有的溶解度随温度的升高而减小,所以可能会析出的晶体为MgSO4.
×100%,所以MgCl2的溶质质量分数最大;在MgCl2、KCl和MgSO4三种物质中,从t1℃加热到t2℃以上时,只有的溶解度随温度的升高而减小,所以可能会析出的晶体为MgSO4.
故答案为(1)石油;(2)①2;②A C D;③22;(3)MgCl2;MgSO4.

【题目】学习了金属的有关知识后,同学们知道了如何鉴别黄金和黄铜(铜锌合金,俗名“愚人金”)。某化学兴趣小组的同学为了进一步测定某黄铜的组成,称取了黄铜样品50g放入锥形瓶中,向其中分5次共加入250g稀硫酸,测得数据记录如下表。
次数 质量 | 第1次 | 第2次 | 第3次 | 第4次 | 第5次 |
累计加入稀硫酸的质量/g | 50 | 100 | 150 | 200 | 250 |
累计产生气体的质量/g | 0.2 | x | 0.6 | 0.7 | 0.7 |
回答下列问题:
(1)x=__,该样品中铜的质量为__g。
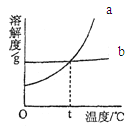
(2)请在如图中画出样品中加入250g稀硫酸,产生气体的质量与稀硫酸的质量变化关系示意图。

(3)黄铜样品与稀硫酸恰好完全反应时,所得溶液的溶质的质量分数是_____?(精确到0.01)
【题目】KCl和KNO3在不同温度下的溶解度数据如表所示,下列说法中正确的是
温度/℃ | 20 | 30 | 60 | |
溶解度/g | KCl | 33 | 38 | 45 |
KNO3 | 31 | 64 | 110 |
A. 60℃时,100g水中最多溶解45 g KCl
B. 随着温度的升高,某饱和KCl溶液中会有固体析出
C. KNO3的溶解度始终大于KCl
D. 60℃时,某KNO3溶液中溶质的质量分数一定为 ![]()
【题目】某碳酸钠样品混有氯化钠,为测量样品中Na2CO3的质量分数,小林进行了如下实验。向3个烧杯中分别加入3份质量不同的样品,然后分别加入相同质量分数的稀盐酸100g,充分反应后,实验数据记录如下:
实验一 | 实验二 | 实验三 | |
稀盐酸质量/g | 100 | 100 | 100 |
反应前固体样品质量/g | 5 | 10 | 15 |
反应后烧杯内物质的质量/g | m | 107.8 | 112.3 |
(1)表中的m值为________;
(2)计算样品中Na2CO3的质量分数____。