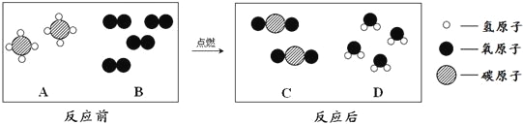
题目内容
【题目】某碳酸钠样品混有氯化钠,为测量样品中Na2CO3的质量分数,小林进行了如下实验。向3个烧杯中分别加入3份质量不同的样品,然后分别加入相同质量分数的稀盐酸100g,充分反应后,实验数据记录如下:
实验一 | 实验二 | 实验三 | |
稀盐酸质量/g | 100 | 100 | 100 |
反应前固体样品质量/g | 5 | 10 | 15 |
反应后烧杯内物质的质量/g | m | 107.8 | 112.3 |
(1)表中的m值为________;
(2)计算样品中Na2CO3的质量分数____。
【答案】103.9;53%。
【解析】
当加入10g固体样品时产生二氧化碳的质量为2.2g,当加入15g固体样品时产生二氧化碳的质量为2.7g,所以当加入5g固体样品时产生二氧化碳的质量为1.1g,根据反应生成的二氧化碳的质量可以求出样品中碳酸钠的质量和质量分数。
(1)m=100g+5g-1.1g=103.9g。
(2)设样品中碳酸钠的质量为x
Na2CO3+2HCl=2NaCl+H2O+CO2![]()
106 44
x 2.2g
![]()
![]()
![]() 53%
53%
样品中Na2CO3的质量分数为53%。

 名校课堂系列答案
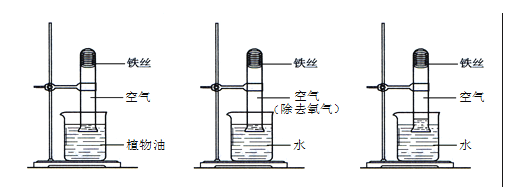
名校课堂系列答案【题目】用下图装置探究可燃物燃烧的条件。
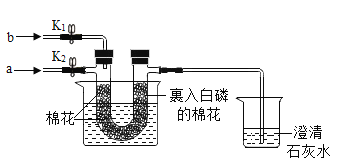
资料:棉花的着火点为210℃。
[步骤1]将U型管放入盛有冷水的烧杯中,打开K2,关闭K1,从a口通入氧气,两端均无明显现象。
[步骤2]关闭K2,打开K1,从b口通入二氧化碳,看到澄清石灰水变浑浊,然后将U型管放入盛有80℃热水的烧杯中,两端均无明显现象。
[步骤3]打开K2,关闭K1,从a口通入氧气,右端白磷先燃烧,一会儿棉花开始燃烧,此时左端棉花没有燃烧。
(1)步骤2中,通入二氧化碳的目的是________。
(2)请解释步骤3中,右端棉花燃烧的原因是_______。
(3)依据上述实验,完成下表:
该实验可以证明的燃烧条件 | 对应现象 |
温度达到着火点 | ____________ |
_____________ | 步骤2中的白磷不燃烧,步骤3中的白磷燃烧 |
【题目】中和反应在工农业生产和生活中有广泛的应用。某化学实验小组的同学对酸碱中和反应进行了如下研究。
(实验过程1)对于没有明显实验现象的中和反应,如稀盐酸与稀氢氧化钠溶液的反应,要证明它们之间确实发生了化学反应,可通过如图所示实验步骤进行操作。
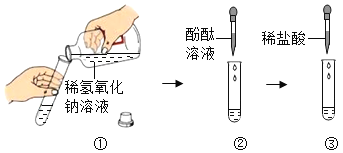
请根据上图所示实验步骤填写实验报告:
实验步骤 | 实验现象 | 实验结论 |
①向试管中加入1~2ml稀氢氧化钠溶液 | ___________________ | NaOH与HCl发生了中和反应 |
②____________ | ___________________ | |
③____________ | ___________________ |