题目内容
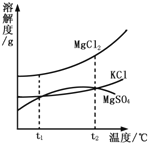
【题目】KCl和KNO3在不同温度下的溶解度数据如表所示,下列说法中正确的是
温度/℃ | 20 | 30 | 60 | |
溶解度/g | KCl | 33 | 38 | 45 |
KNO3 | 31 | 64 | 110 |
A. 60℃时,100g水中最多溶解45 g KCl
B. 随着温度的升高,某饱和KCl溶液中会有固体析出
C. KNO3的溶解度始终大于KCl
D. 60℃时,某KNO3溶液中溶质的质量分数一定为 ![]()
【答案】A
【解析】
本题可根据溶解度概念,结合图表中溶解度数的数值进行分析。
A、由图表信息可知,40℃时,氯化钾的溶解度为45g,在该温度下,100g水中最多可溶解45g氯化钾就达到饱和状态,正确;B、由不同温度下的溶解度数值可以发现规律:KCl的溶解度随着温度的升高,溶解度逐渐增大,所以随着温度的升高,某饱和KCl溶液会变为不饱和,不会有固体析出,错误;C、由表中数据可知20℃时,KNO3的溶解度小于KCl,错误;D、60℃时,只有饱和KNO3溶液中溶质的质量分数为![]() ×100%,错误;故选A。
×100%,错误;故选A。

【题目】用下图装置探究可燃物燃烧的条件。
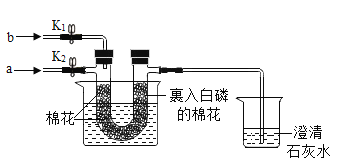
资料:棉花的着火点为210℃。
[步骤1]将U型管放入盛有冷水的烧杯中,打开K2,关闭K1,从a口通入氧气,两端均无明显现象。
[步骤2]关闭K2,打开K1,从b口通入二氧化碳,看到澄清石灰水变浑浊,然后将U型管放入盛有80℃热水的烧杯中,两端均无明显现象。
[步骤3]打开K2,关闭K1,从a口通入氧气,右端白磷先燃烧,一会儿棉花开始燃烧,此时左端棉花没有燃烧。
(1)步骤2中,通入二氧化碳的目的是________。
(2)请解释步骤3中,右端棉花燃烧的原因是_______。
(3)依据上述实验,完成下表:
该实验可以证明的燃烧条件 | 对应现象 |
温度达到着火点 | ____________ |
_____________ | 步骤2中的白磷不燃烧,步骤3中的白磷燃烧 |