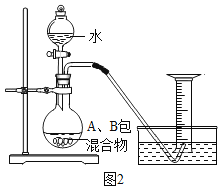
题目内容
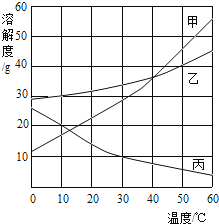
【题目】在氢氧化钠溶液和稀盐酸的反应中,小明和老师用数字化设备测定了溶液温度及pH值随时间变化变化的关系曲线图。
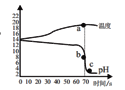
(1)根据曲线图,可知该实验是将_______(选填“氢氧化钠溶液”或“稀盐酸”)滴加到另外一种试剂中。该反应为___________。
A 吸热反应 B 放热反应
(2)a为温度曲线上的最高点,a、b两点对应的时间相同,则b对应的纵坐标数值为____。
(3)分别取样,依次进行以下实验:
①将b点处溶液中的溶质结晶,采用__________方法。
②取c点样品于试管中,加足量水稀释后溶液的pH__________7(填“>”、“<”或“=”)。
(4)若发现氢氧化钠溶液试剂瓶敞口放置,经检验该试剂中含有碳酸钠,请设计实验检验该样品中仍含有氢氧化钠_______。
(5)将50g稀盐酸加入50g氢氧化钠溶液中恰好完全反应,所得溶液中溶质的质量分数为5.85%。试计算氢氧化钠溶液中溶质的质量分数_______。
【答案】稀盐酸 B 7 蒸发结晶 < 取少量的溶液于试管中,加入过量氯化钙溶液,再取上层清液,滴加几滴酚酞观察溶液颜色变化,若变红色,则证明仍有氢氧化钠 8%
【解析】
(1)根据曲线图,未滴加时pH大于7,说明一开始是呈碱性,滴加之后pH逐渐降低至小于7,可知该实验是将稀盐酸滴加到氢氧化钠溶液中。根据温度的变化曲线,可知温度逐渐上升,说明该反应为放热反应。故填:稀盐酸;B
(2)a为温度曲线上的最高点,可知此时已经完全反应,由于a、b两点对应的时间相同,则b对应的纵坐标数值为pH值等于7。故填:7
(3)①b点处溶液中的溶质为氯化钠,由于氯化钠的溶解度随温度的变化不大,故将氯化钠结晶,采用蒸发结晶的方法来获得晶体。故填:蒸发结晶
②c点样品的溶液为酸性,取少量酸性溶液于试管中,加足量水稀释后溶液的无限接近于7但不会大于或等于7。故填:<
(4)若发现氢氧化钠溶液试剂瓶敞口放置,经检验该试剂中含有碳酸钠,由于碳酸钠溶液也为碱性,故不能直接通过测定pH值来检验是否有氢氧化钠;设计实验是:取少量的溶液于试管中,加入过量氯化钙溶液,再取上层清液,滴加几滴酚酞观察溶液是否变红,若变红色,则证明仍有氢氧化钠;故填:取少量的溶液于试管中,加入过量氯化钙溶液,再取上层清液,滴加几滴酚酞观察溶液颜色变化,若变红色,则证明仍有氢氧化钠
(5)将50g稀盐酸加入50g氢氧化钠溶液中恰好完全反应,所得溶液中的溶质为氯化钠,反应生成氯化钠的质量为(50g+50g)![]() 5.85%=5.85g;设参加反应的氢氧化钠质量为x;
5.85%=5.85g;设参加反应的氢氧化钠质量为x;
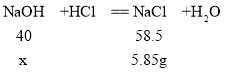
![]()
X=4g
氢氧化钠溶液中溶质的质量分数为:![]() ;
;
答:氢氧化钠溶液中溶质的质量分数为8%。故填:8%

 阅读快车系列答案
阅读快车系列答案