题目内容
【题目】兴趣小组的同学学习了碳酸钠的性质后,对碳酸氢钠的性质也进行探究。
(问题1)碳酸氢钠溶液与碳酸钠溶液的酸碱性
(实验1)用pH试纸测定等浓度的碳酸氢钠和碳酸钠溶液的pH,分别为9和12;
(结论1)两种溶液都呈碱性,它们的碱性强弱顺序为_____。
(问题2)碳酸氢钠溶液、碳酸钠溶液与酸的反应
(实验2)等浓度的碳酸氢钠和碳酸钠溶液分别与相同浓度的盐酸反应
操作和现象如下表:
序号 | 操作 | 现象 |
实验① | 碳酸氢钠溶液逐滴加入盐酸中 | 立刻产生气泡 |
实验② | 碳酸钠溶液逐滴加入盐酸中 | 立刻产生气泡 |
实验③ | 盐酸逐滴加入碳酸氢钠溶液中 | 立刻产生气泡 |
实验④ | 盐酸逐滴加入中碳酸钠溶液中 | 滴加一会后才有气泡产生 |
(问题3)实验④与另外三个实验现象不同的原因
(实验3)将等浓度的碳酸氢钠和碳酸钠溶液与相同浓度的盐酸互滴,利用手持传感器测定反应中溶液pH变化,四个实验的pH变化与时间的关系如图所示。
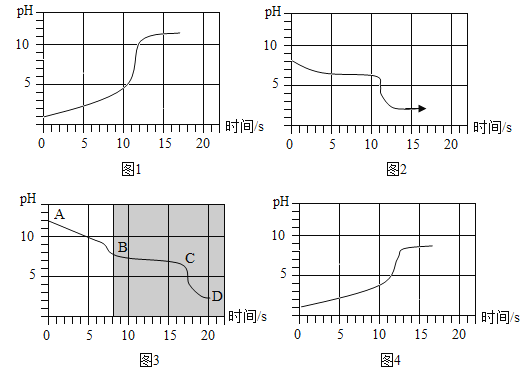
(分析)
(1)如图表示的实验是_____(填实验2中的序号)。
(2)比较如图与如图发现:如图中的阴影部分与如图叠合后,图象基本重合。
则如图中的AB段发生反应的化学方程式为_____,BC段发生反应的化学方程式为_____,D点的溶质为_____(写化学式);所以,“盐酸逐滴加入碳酸钠溶液中,滴加一会后才有气泡产生”的原因是_____。
(3)比较如图与如图发现:不同的操作有不同现象,试分析造成这一现象的原因:_____。
(应用)
用稀盐酸来鉴别一瓶溶液是氢氧化钠还是碳酸钠时,应如何操作? _____。
【答案】碳酸钠>碳酸氢钠 实验① Na2CO3+HCl═NaCl+NaHCO3 NaHCO3+HCl═NaCl+H2O+CO2↑ HCl、NaCl 盐酸先和碳酸钠反应生成碳酸氢钠和氯化钠,后和碳酸氢钠反应生成氯化钠、水和二氧化碳 向盐酸中滴加碳酸钠溶液时盐酸过量,向碳酸钠溶液中滴加盐酸时碳酸钠过量 取两种溶液少量分别滴加到稀盐酸中
【解析】
[结论1]
碳酸氢钠和碳酸钠溶液的pH,分别为9和12,说明两种溶液都呈碱性,它们的碱性强弱顺序为碳酸钠>碳酸氢钠。
故填:碳酸钠>碳酸氢钠。
[分析]
(1)由图中信息可知,图1表示向盐酸中滴加碳酸钠溶液,图2表示向碳酸氢钠溶液中滴加盐酸,图3表示向碳酸钠溶液中滴加盐酸,图4表示的实验是向盐酸中滴加碳酸氢钠溶液。
故填:实验①。
(2)比较图3与图2发现:图3中的阴影部分与图2叠合后,图象基本重合,则图3中的AB段是碳酸钠和盐酸反应生成碳酸氢钠和氯化钠,反应的化学方程式为:Na2CO3+HCl═NaCl+NaHCO3;
BC段是碳酸氢钠和盐酸反应生成氯化钠、水和二氧化碳,发生反应的化学方程式为:NaHCO3+HCl═NaCl+H2O+CO2↑;
D点的溶质为反应生成的氯化钠和过量的氯化氢;
所以,“盐酸逐滴加入碳酸钠溶液中,滴加一会后才有气泡产生”的原因是盐酸先和碳酸钠反应生成碳酸氢钠和氯化钠,后和碳酸氢钠反应生成氯化钠、水和二氧化碳。
故填:Na2CO3+HCl═NaCl+NaHCO3;NaHCO3+HCl═NaCl+H2O+CO2↑;HCl、NaCl;盐酸先和碳酸钠反应生成碳酸氢钠和氯化钠,后和碳酸氢钠反应生成氯化钠、水和二氧化碳。
(3)比较图1与图3发现:不同的操作有不同现象,造成这一现象的原因:向盐酸中滴加碳酸钠溶液时盐酸过量,向碳酸钠溶液中滴加盐酸时碳酸钠过量。
故填:向盐酸中滴加碳酸钠溶液时盐酸过量,向碳酸钠溶液中滴加盐酸时碳酸钠过量。
[应用]
用稀盐酸来鉴别一瓶溶液是氢氧化钠还是碳酸钠时,操作方法:取两种溶液少量分别滴加到稀盐酸中,产生气泡的是碳酸钠溶液,无明显现象的是氢氧化钠溶液。
故填:取两种溶液少量分别滴加到稀盐酸中。

 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案