题目内容
【题目】实验室中有甲、乙两瓶过氧化氢溶液,均标有“10%”字样。相同条件下,用这两瓶过氧化氢溶液制取150mL氧气,所用时间明显不同。对此,同学们进行如下探究。
【猜想】两瓶过氧化氢溶液浓度不同
【进行实验】
序号 | 实验装置 | 主要实验步骤 | 实验现象 |
实 验 1 |
| 向两支试管中分别加入等量的甲、乙两瓶中的过氧化氢溶液,对比观察 | 两支试管中均有细微的气泡产生 |
实 验 2 |
| 将两个相同的蜡烛分别点燃后放入两个烧杯中,然后分别向两个烧杯中加入等量的甲、乙两瓶中的过氧化氢溶液,再向过氧化氢溶液中加入等量的二氧化锰固体 | 两烧杯内液体中均产生气泡、有白雾,两烧杯内蜡烛均继续燃烧,但加入甲瓶溶液的烧杯中,蜡烛燃烧得更明亮 |
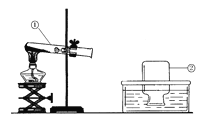
实 验 3 |
| 向装有等量二氧化锰的两个锥形瓶中分别加入等量的甲、乙两瓶中的过氧化氢溶液 | 两锥形瓶内液体中均产生气泡、有白雾,同时有现象①出现 |
【实验结论】
甲瓶溶液浓度大于乙瓶溶液浓度。
【分析与解释】
(1)实验2和实验3中,均发生反应的文字表达式(或符号表达式)为 。
(2)实验2中,影响蜡烛燃烧明亮程度的因素是 。
(3)实验3中,现象①为 。
【反思与评价】
(1)实验1未观察到现象明显不同的主要原因是 。
(2)通过以上实验得到如下启示:影响反应速率的因素有 ;欲使燃着的物质燃烧更旺,可采用的方法是 。
【答案】【分析与解释】
(1)H2O2 ![]() H2O + O2
H2O + O2
(2)过氧化氢溶液浓度不同,产生氧气的量(或速率)不同
(3)加入甲瓶中过氧化氢溶液的天平读数变化较快,稳定时数值较小
【反思与评价】
(1)常温下,过氧化氢分解速率缓慢
(2)反应物的浓度、催化剂;增加氧气的浓度
【解析】
试题分析:【分析与解释】由结论那么在同样条件下甲液分解产生氧气的速率和量更高;
(1)为过氧化氢在二氧化锰催化下分解生成水和氧气H2O2 ![]() H2O + O2;
H2O + O2;
(2)明亮度不同说明燃烧的剧烈程度不同即产生的氧气的量不同,同样条件下那么说明过氧化氢溶液浓度不同;
(3)因为甲产生氧气的速率更快,产生氧气的量更多,那么加入甲瓶中过氧化氢溶液的天平读数变化较快,稳定时数值较小;
【反思与评价】
(1)常温下,过氧化氢分解速率缓慢,此时浓度对反应速率的影响无法明显判断;
(2)由题可得有反应物的浓度、催化剂;氧气浓度越高燃烧约剧烈。