题目内容
【题目】有A、B、C、D四种元素,A是地壳中含量最丰富的元素;B的单质在A中剧烈燃烧,发出明亮的蓝紫色火焰,生成有刺激性气味的气体E;C的原子核内有9个质子;D的原子核外有13个电子。根据以上条件回答:
(1)写出A、B的元素符A: B:
(2)写出D元素的离子符号 气体E的化学式是
(3)写出A和B反应生成E的化学反应方程式: 反应类型是
【答案】(1)O S(2)Al3+ SO2(3)S+O2![]() SO2 化合反应
SO2 化合反应
【解析】
试题分析:A是地壳中含量最丰富的元素,A是铝元素;B的单质在A中剧烈燃烧,发出明亮的蓝紫色火焰,说明A是氧气,B是硫,生成有刺激性气味的气体E是二氧化硫;C的原子核内有9个质子,说明C是氟;D的原子核外有13个电子,说明D中含有13个质子,是铝原子。

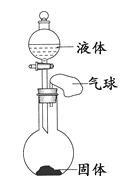
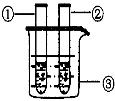
【题目】某同学设计下表所示实验,探究金属铜对H2O2分解速率的影响。
操 作 | 装 置 | 现 象 |
1.取一个铜丝网,卷成筒形,固定在铁丝上。 |
| |
2.分别向①和②中注入15mL、30%的H2O2溶液,并放入盛有热水的③中。 |
| 约1min后可观察到①和②中都有少量气泡产生。 |
3.把铜丝网插入①中。 |
| ①中有大量气泡产生,5min后不再有气泡产生;此时②中仍然不断有少量气泡产生。 |
回答下列问题:
(1) 仪器①的名称是_______________;仪器③的名称是_______________。
(2) 在步骤3中仪器 ②实验的目的是_________________________。
(3) 能否可以得出铜可以加快H2O2分解的速率__________(填“是”或“否”),理由是_________________
(4) 如果用上述实验探究铜是不是H2O2分解的催化剂,需要对上述实验方案进行补充,其中必要的是_______________。
A.称量实验前铜丝网的质量和实验后干燥铜丝网的质量
B.向仪器②中加入二氧化锰
C.将铁丝换成铜丝
D.将过氧化氢溶液加水稀释
E.检验铜的化学性质是否发生变化。