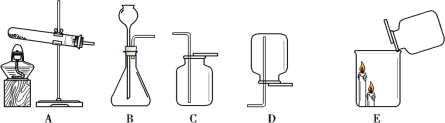题目内容
【题目】白磷、红磷都是可燃物,以下是教材中利用它们的可燃性进行的三个实验,请分别回答问题.
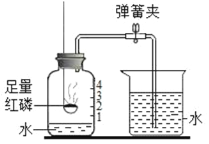
(1)材料中利用实验一是为了测定___________。待集气瓶中的红磷熄灭,冷却后打开弹簧夹,当观察到______的现象时,可达到该实验目的。
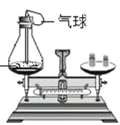
(2)通过实验二可以验证质量守恒定律。实验前将红磷放入锥形瓶中,称量装置的总质量,引燃红磷,待 反 应后 再称 量冷却后 装置 的总 质量,发 现托 盘天 平保持平衡。锥 形瓶 中红磷熄灭的原因可能是_______________。
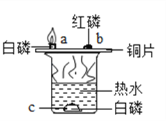
(3)通过实验三可以探究燃烧的条件。实验中只有a处的白磷燃烧,b处的红磷和c处的白磷均不燃烧。a处白磷燃烧的化学方程式为___________________ ,a与c对比说明燃烧需要的条件是可燃物与氧气接触;a与b对比说明燃烧需要的条件是____________________ ,为使c处白磷燃烧可用导管向c处通氧气,除此方法外,你还能想到的一个方法是__________________ 。
(4)综合分析上述三个实验,以下说法正确的是___________ .(填序号)
①实验一中只将红磷换成木炭仍能达到实验目的
②实验一中两容器中水起的作用相同
③实验二若未达到实验目的,可能是由于装置气密性不好
④实验二锥形瓶底放少量细沙的作用是防止瓶底炸裂
⑤实验二中气球作用之一是防止红磷燃烧放出的热使气体膨胀冲开橡胶塞
⑥实验一、二中的红磷换为白磷也能达到实验目的
【答案】空气中氧气含量 烧杯中的水进入集气瓶中,液面约上升到刻度 1 处 红磷燃烧消耗氧气,锥形瓶中氧气量逐渐减小,最后氧气不足导致红磷熄灭 4P+5O2![]() 2P2O5 温度达到可燃物的着火点 用镊子将白磷夹出水面,放置于空气中 ③④⑤⑥
2P2O5 温度达到可燃物的着火点 用镊子将白磷夹出水面,放置于空气中 ③④⑤⑥
【解析】
(1)实验1可以测出空气中氧气的含量,即氧气约占空气总量的体积分数,待集气瓶中的红磷熄灭,冷却后打开弹簧夹,烧杯中的水进入集气瓶中,液面约上升到刻度1处;
(2)通过实验二可以验证质量守恒定律。实验前将红磷放入锥形瓶中,称量装置的总质量,引燃红磷,待反应后再称量冷却后装置的总 质量,发现托盘天平保持平衡。锥形瓶中红磷熄灭的原因可能是红磷燃烧消耗氧气,锥形瓶中氧气量逐渐减小,最后氧气不足导致红磷熄灭;
(3)白磷与空气中的氧气反应生成五氧化二磷,a 处白磷燃烧的化学方程式为4P+5O2![]() 2P2O5;燃烧需要三个条件同时具备,即可燃物、氧气、温度达到着火点,a 与 b 对比说明燃烧需要的条件是温度达到可燃物的着火点,为使c 处白磷燃烧可用导管向c 处通氧气,还可以用镊子将白磷夹出水面,放置于空气中;
2P2O5;燃烧需要三个条件同时具备,即可燃物、氧气、温度达到着火点,a 与 b 对比说明燃烧需要的条件是温度达到可燃物的着火点,为使c 处白磷燃烧可用导管向c 处通氧气,还可以用镊子将白磷夹出水面,放置于空气中;
(4)分析以上三个实验知:实验一中红磷不可以换成木炭,因为木炭燃烧生成二氧化碳气体,所以①说法不正确;②实验三中的热水只起隔绝空气和加热的作用,所以②说法不正确;③实验二若未达到实验目的,可能是由于装置气密性不好,所以③说法正确;④实验二中的锥形瓶底放少量细沙的作用是防止瓶底炸裂,说法④正确;⑤实验二中气球作用之一是防止红磷燃烧放出的热使气体膨胀冲开橡胶塞气球起到了平衡瓶内外气体压强的作用,⑤说法正确;⑥实验一、二中的红磷换为白磷也能达到实验目的,⑥正确;所以选③④⑤⑥。

 阅读快车系列答案
阅读快车系列答案【题目】碳酸氢钠是化学实验中常见的药品,在工业上有很多制取方法。重庆一中兴趣小组的同学 们查询资料发现了一种“气相固碳法”:向氢氧化钠溶液中通入过量的CO2气体。
整理资料:Ⅰ、过量CO2通入NaOH溶液,发生两步反应:
①_________________________________(写出化学方程式);
②Na2CO3 +H2O + CO2=2NaHCO3
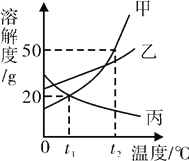
Ⅱ、碳酸钠和碳酸氢钠的溶解度表(部分)
温度/℃ | 0 | 15 | 20 | 30 |
Na2CO3 溶解度/g | 7.1 | 13.25 | 21.8 | 39.7 |
NaHCO3 溶解度/g | 6.9 | 8.72 | 9.6 | 11.1 |
15℃时,将10g氢氧化钠固体完全溶解溶于100g水中(如图1),而后匀速的通入二氧化碳气体,同时用pH计测定溶液的pH值变化(如图2)。

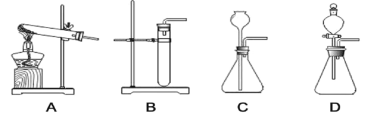
(1)图 1 所示实验中,产生 CO2 的装置应该选择:_____(填序号);
(2)为了确定M处溶液的溶质成分,取少量样品于试管中,进行如下实验:
步骤 | 加入试剂 | 实验现象 | 实验结论 |
① | 加入_______溶液 | 溶液变红 | NaOH和Na2CO3 |
② | 加入过量_______溶液 | ______ |
(3)实验中,t2后溶液的pH基本不变,则此时烧杯中观察到的现象是_____。
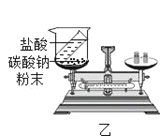
【题目】下列实验设计不能达到实验目的的是( )
选项 | A | B | C | D |
实验 设计 |
|
|
|
|
实验 目的 | 证明 CO2 比空 气的密度大 | 探究质量守恒定律 | 验证 CO2 能溶于水 | 证明石墨具有导电 性 |
A. A B. B C. C D. D
【题目】化学教材 “寻找新的催化剂”研究性实验,引起了化学探究小组的兴趣。
(提出问题)(1)氧化铁能否作过氧化氢溶液分解的催化剂?
(2)氧化铁与二氧化锰催化效果哪个好?
(3)催化剂的质量是否对过氧化氢溶液分解的速率产生影响?
(实验探究)
实验步骤 | 实验现象 |
①分别量取5 mL5%过氧化氢溶液放入A、B 两支试管中,向A试管中加入a g氧化铁粉末,并分别在A、B两支试管中插入带火星的木条,观察现象。 | A试管中产生大量气泡,带火星木条复燃,B试管中的现象: |
②待A试管中没有现象发生时,重新加入过氧化氢溶液,并把带火星的木条伸入试管内,如此反复多次实验,观察现象。 | 试管中均产生大量气泡,带火星木条均复燃 |
③将实验②中的剩余物小心过滤,并将所得滤渣进行洗涤、干燥、称量,所得固体质量仍为a g。 | |
④分别量取5 mL5%过氧化氢溶液放入C、D 两支试管中,向C试管中加入a g氧化铁粉末,向D试管中加入a g二氧化锰粉末,观察现象。 |
|
(1)A中产生的气体是 _________;B试管中的现象___________。
(2)实验②、③证明:氧化铁的 ______ 和 _____ 在反应前后均没有发生变化,可以作过氧化氢分解的催化剂;
(3)实验设计④的目的是_________ ,若实验④观察到D试管中产生气泡的速率更快,由此你可以得到的结论是 ________ 。
(4)兴趣小组同学设计了如下图实验装置,利用压强传感器测不同质量二氧化锰对双氧水分解快慢的影响。在8mL3%的双氧水中分别加入了0.08g,0.12g,0.24gMnO2.测得容器内压强的变化曲线如下右图所示(曲线的斜率表征催化反应的速率)。请观察图,回答问题:
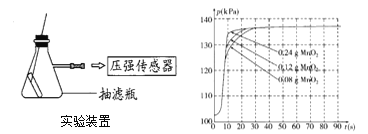
(Ⅰ)根据图1可发现:该实验条件下,30s内催化分解8mL浓度为3%的双氧水,MnO2的最小用量为___克。
(Ⅱ)根据图1,下列说法正确的是________。
a.一定范围内,二氧化锰用量越多,双氧水分解越快;
b.反应容器的气密性,对实验所测数据的精确度有影响;
c.称量的二氧化锰质量的精确度对实验装置中最终的压强大小没有影响。