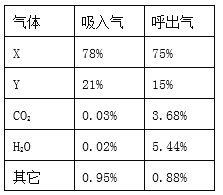
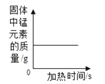
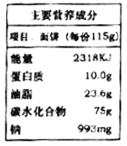
题目内容
【题目】铜是人类最早利用的金属之一。
(1)下列铜制品中,利用金属导热性的是___(填字母序号)。

A.铜质奖牌 B.铜导线 C.铜火锅
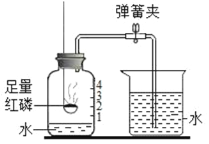
(2)“湿法炼铜”的原理是硫酸铜溶液与铁反应,该反应的化学方程式为_____,实验中反应的现象是____
【答案】C Fe+ CuSO4 == Cu + FeSO4 铁表面有红色固体析出,溶液由蓝色变为浅绿色。
【解析】
(1)A、铜质奖牌是利用了铜的具有金属光泽的特性,故错误;B、铜用于做导线是利用了铜的导电性,故错误;C、铜火锅是利用了铜的导热性,故正确。故选C。
(2)铁与硫酸铜反应生成硫酸亚铁和铜,反应的方程式为: Fe+ CuSO4 == Cu + FeSO4。由于有铜和硫酸亚铁生成,故铁表面有红色固体析出,溶液由蓝色变为浅绿色。

【题目】俄国化学家门捷列夫在总结前人经验的基础上,通过艰辛的努力,终于编制出了现代元素周期表的雏形表。下表为元素周期表的部分元素的部分信息,利用下表回答相关问题。
第一周期 | 1 H 氢 1.008 | 2 He 氦 4.003 | ||||||
第二周期 | 3 Li 锂 6.941 | 4 Be 铍 9.012 | 5 B 硼 10.81 | 6 C 碳 12.01 | 7 N 氮 14.01 | 8 O 氧 16.00 | 9 F 氟 19.00 | 10 Ne 氖 20.18 |
第三周期 | 11 Na 钠 22.99 | 12 Mg 镁 24.31 | 13 Al 铝 26.98 | 14 Si 硅 28.09 | 15 P 磷 30.97 | 16 S 硫 32.06 | 17 Cl 氯 35.45 | 18 Ar 氩 39.95 |
(1)请画出16号元素的原子结构示意图__________,化学反应中该原子比较容易__________电子变成离子;
(2)![]() 表示的是________,其与17号元素形成的化合物是________
表示的是________,其与17号元素形成的化合物是________
(3)同一纵列元素原子的结构特点是________________
(4)上表中第二、三周期元素最外层电子数的变化规律是___________