题目内容
【题目】化学教材 “寻找新的催化剂”研究性实验,引起了化学探究小组的兴趣。
(提出问题)(1)氧化铁能否作过氧化氢溶液分解的催化剂?
(2)氧化铁与二氧化锰催化效果哪个好?
(3)催化剂的质量是否对过氧化氢溶液分解的速率产生影响?
(实验探究)
实验步骤 | 实验现象 |
①分别量取5 mL5%过氧化氢溶液放入A、B 两支试管中,向A试管中加入a g氧化铁粉末,并分别在A、B两支试管中插入带火星的木条,观察现象。 | A试管中产生大量气泡,带火星木条复燃,B试管中的现象: |
②待A试管中没有现象发生时,重新加入过氧化氢溶液,并把带火星的木条伸入试管内,如此反复多次实验,观察现象。 | 试管中均产生大量气泡,带火星木条均复燃 |
③将实验②中的剩余物小心过滤,并将所得滤渣进行洗涤、干燥、称量,所得固体质量仍为a g。 | |
④分别量取5 mL5%过氧化氢溶液放入C、D 两支试管中,向C试管中加入a g氧化铁粉末,向D试管中加入a g二氧化锰粉末,观察现象。 |
|
(1)A中产生的气体是 _________;B试管中的现象___________。
(2)实验②、③证明:氧化铁的 ______ 和 _____ 在反应前后均没有发生变化,可以作过氧化氢分解的催化剂;
(3)实验设计④的目的是_________ ,若实验④观察到D试管中产生气泡的速率更快,由此你可以得到的结论是 ________ 。
(4)兴趣小组同学设计了如下图实验装置,利用压强传感器测不同质量二氧化锰对双氧水分解快慢的影响。在8mL3%的双氧水中分别加入了0.08g,0.12g,0.24gMnO2.测得容器内压强的变化曲线如下右图所示(曲线的斜率表征催化反应的速率)。请观察图,回答问题:
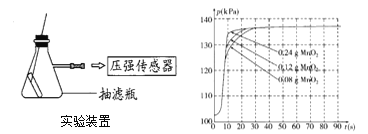
(Ⅰ)根据图1可发现:该实验条件下,30s内催化分解8mL浓度为3%的双氧水,MnO2的最小用量为___克。
(Ⅱ)根据图1,下列说法正确的是________。
a.一定范围内,二氧化锰用量越多,双氧水分解越快;
b.反应容器的气密性,对实验所测数据的精确度有影响;
c.称量的二氧化锰质量的精确度对实验装置中最终的压强大小没有影响。
【答案】氧气 带火星的木条没有复燃 质量 化学性质 探究氧化铁与二氧化锰催化剂效果哪个好 二氧化锰催化效果好 0.01 abc
【解析】
(1)根据氧气具有助燃性,能使带火星木条复燃进行解答;
(2)根据实验②、③证明:氧化铁的质量和化学性质在反应前后均没有发生变化,可以作过氧化氢分解的催化剂进行解答;
(3)二氧化锰也能做过氧化氢分解生成氧气的催化剂,所以设计实验④的目的是氧化铁与二氧化锰哪一个更适合做过氧化氢分解生成氧气的催化剂.根据若实验Ⅳ观察到D试管中产生气泡的速率更快,由此你可以得到的结论是二氧化锰更适合做过氧化氢分解生成氧气的催化剂进行解答;
(5)根据图2信息可以判断相关方面的问题。
(1)氧气具有助燃性,能使带火星木条复燃,所以有实验现象A试管中产生气泡,带火星木条复燃,可知A中产生的气体是氧气,B试管中带火星的木条没有复燃;
(2)实验②、③证明:氧化铁的质量和化学性质在反应前后均没有发生变化,可以作过氧化氢分解的催化剂;
(3)二氧化锰也能做过氧化氢分解生成氧气的催化剂,所以设计实验④的目的是氧化铁与二氧化锰哪一个更适合做过氧化氢分解生成氧气的催化剂;
(4)(Ⅰ)根据图2可发现,实验条件下,30s内催化分解8mL溶质质量分数为3%的双氧水,MnO2的最小用量为0.01g;
(Ⅱ)a、一定范围内,二氧化锰用量越多,双氧水分解越快,正确;
b、反应容器的气密性,对实验所测数据的精确度有影响,正确;
c、称量的二氧化锰质量的精确度对实验装置中最终的压强大小没有影响,正确。

 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案【题目】小林同学在体育课上腿部擦伤,医务室的大夫在她伤口上涂了医用过氧化氢溶液,小林看到伤口处产生了小气泡,很好奇。为什么瓶中的过氧化氢溶液涂到伤口上,分解就加快了呢?

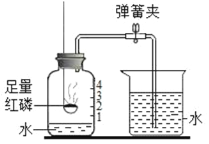
I.小林准备用如下图所示装置测定过氧化氢分解的快慢,实验前在注射器中吸入过氧化氢溶液,量筒内装满水。实验开始时,向试管中注入过氧化氢溶液,并用排水法收集氧气。记录2分钟收集的气体体积。
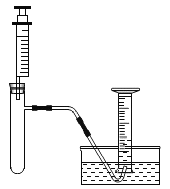
(1)请写出过氧化氢分解的反应方程式:______________。
(2)若要检验生成的气体是否为氧气,可将导气管从水中取出,取带火星的木条放在导气管口处,观察到__________,说明生成的气体是氧气。
II.小林查阅了相关资料,并进行了探究实验
(查阅资料)
(1)过氧化氢是人体代谢废物之一,它能够对机体造成损害,人体存在过氧化氢酶,可以催化过氧化氢分解。
(2)温度对化学反应的快慢有影响,人体正常体温是37℃。
(提出猜想)猜想1: 过氧化氢分解加快是因为体温比瓶中的温度高。
猜想2:过氧化氢分解加快是因为伤口中有过氧化氢酶。
(进行实验)
序号 | 实验步骤 | 实验现象 | 实验结论 |
① | 分两次进行实验,均注入5 mL过氧化氢溶液 第一次在常温下进行 第二次将试管浸在37℃的温水中 | 量筒中2分钟收集到的气体体积均为5 mL | _____ |
② | 分两次进行实验 第一次将装有一小粒过氧化氢酶的试管浸在37℃的温水中,注入5 mL过氧化氢溶液 第二次__________ | 第一次,量筒中2分钟收集到的气体体积为56 mL 第二次,量筒中2分钟收集到的气体体积为5 mL | 过氧化氢分解加快是因为过氧化氢酶的作用 |
(3)实验①得出的结论是___________。
(4)实验②中第一次收集到的氧气体积为__________ mL。
(5)实验②中横线部分应进行的操作是__________。
(实验反思)
小林反思了实验过程,认为人体中过氧化氢酶是在体温条件下发挥作用的,实验得出的结论可能存在不足。因此又补充进行了几组实验,数据记录如下表所示。
加入过氧化氢酶 | 不加过氧化氢酶 | |||||
反应温度/ ℃ | 25 | 37 | 42 | 25 | 37 | 42 |
收集到气体体积/ mL | 39 | 56 | 34 | 5 | 5 | 5 |
(6)通过这些数据,你能得出的新结论是__________。