题目内容
【题目】已知酸式盐可以和碱发生化学反应,如:![]() 。有Na2CO3、NaHCO3、CaO和NaOH组成的混合物27.2g,把它们溶于足量的水中,充分反应后,溶液中Ca2+、CO32-、HCO3-均转化为沉淀,将反应容器内水分蒸干,最后得到白色固体物质共29g,则原混合物中含Na2CO3的质量是( )
。有Na2CO3、NaHCO3、CaO和NaOH组成的混合物27.2g,把它们溶于足量的水中,充分反应后,溶液中Ca2+、CO32-、HCO3-均转化为沉淀,将反应容器内水分蒸干,最后得到白色固体物质共29g,则原混合物中含Na2CO3的质量是( )
A.10.6g
B.5.3g
C.15.9g
D.无法确定
【答案】A
【解析】
混合物质量为27.2g,最后得到白色固体混合物共29g,多出来的质量就是参与反应的水的质量,即参与反应的水的质量为:29g-27.2g=1.8g。
![]() ,
,![]() ,该反应的总方程式为:
,该反应的总方程式为:![]() ,由此可知,碳酸氢钠最后转化为沉淀,和1.8g水无关
,由此可知,碳酸氢钠最后转化为沉淀,和1.8g水无关
![]() ,
,![]() ,该反应的总方程式为:
,该反应的总方程式为:![]() ,由此可知,参加反应的1.8g水和此反应有关,
,由此可知,参加反应的1.8g水和此反应有关,
设碳酸钠的质量为x
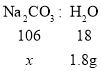
![]()
x=10.6g。
故选A。

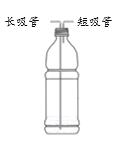
【题目】化学小组用右图所示自制装置进行“人体吸入和呼出气体成分”的探究。
(提出假设)人体呼出气体中含有二氧化碳的含量高于吸入气体。
(进行实验)
实验1
步骤 | 操作 | 现象 |
① | 气密性检验:在饮料瓶中装水至没过长吸管底端, _____ | 水从长吸管端快速 流出 |
② | 将饮料瓶中装满水,对着短管吹气,用排水法收集呼出气体,将燃着的木条快速伸入饮料瓶中。 | 饮料瓶中木条熄灭 |
③ | 将水倒掉,向饮料瓶中加入澄清石灰水至没过长吸管底,从短吸管端吸气30 秒,观察石灰水的变化;再从长吸管端吹气30秒,观察石灰水的变化。 | ________ |
(1)步骤①进行的操作为_______,说明自制装置的气密性良好。
(2)步骤②中的现象________(填“能”或“不能”)证明呼出气体中含二氧化碳,原因是_________。
(3)若假设成立,步骤③中,预期会观察到的现象是________。
实验2
实验1中有同学发现,吹气一段时间后发现,浑浊的石灰水重新变得澄清。他用上述装置加入与实验1等体积的石灰水,做下列实验来研究这一问题。
实验编号 | 石灰水浓度 | 持续吹气时间 | 瓶底现象 |
2-1 | 0.16% | 30秒 | 澄清石灰水变浑浊 |
2-2 | 0.16% | 2分钟 | 澄清石灰水先变浑浊,后又变得澄清 |
2-3 | 0.08% | 30秒 | 澄清石灰水先变浑浊,后又变得澄清 |
2-4 | 0.08% | 2分钟 | 澄清石灰水先变浑浊,后又变得澄清 |
(反思与评价)
(4)能说明石灰水重新变澄清与石灰水浓度有关的实验是________(填实验编号)。
(5)经查阅资料,石灰水重新变澄清是因为生成了碳酸氢钙 [Ca(HCO3)2] (20°C时碳酸氢钙的溶解度为16.6g) 。请写出由浑浊变澄清反应过程的化学方程式_______。
【题目】请你参与某学习小组进行研究性学习的过程,并协助完成相关任务。
(研究课题)探究热水壶底部水垢的主要成分。
(查阅资料)该同学通过查阅资料知道,天然水中一般都含有Ca2+、Mg2+、HCO3-等离子,在加热时,这些离子趋于生成溶解度更小物质-(为碳酸盐、碱等混合物),中一定含有Mg(OH)2和CaCO3同时,他们还查阅到下列有关物质溶解性:
物质 | Ca(HCO3)2 | Mg(HCO3)2 | Ca(OH)2 | Mg(OH)2 | CaCO3 | MgCO3 |
溶解性 | 可溶 | 可溶 | 微溶 | 不溶 | 不溶 | 微溶 |
(提出猜想)除一定含有Mg(OH)2和CaCO3之外,还可能含有Ca(OH)2和_____
(设计方案)
(1)甲同学在烧杯中放入少量研碎,加入适量蒸馏水充分搅拌,取上层清液加入Na2CO3溶液,没有白色沉淀,说明中无Ca(OH)2;
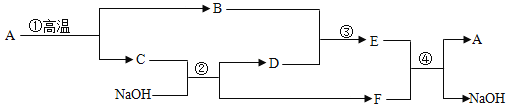
(2)乙同学设计下列实验装置,进一步确定水垢中含有碳酸盐成分,步骤如下:
①按图组装仪器,将50g试样放入锥形瓶中,加入足量酸溶液;
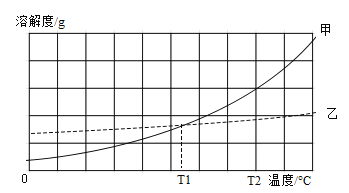
②测量一定时间内干燥管内物质增加质量(见下列曲线);
③待锥形瓶中不再产生气泡时,打开活塞B,从导管A处缓缓鼓入一定量空气;
④再次称量干燥管内物质增加质量;
⑤重复③和④操作,直至干燥管内物质质量不变
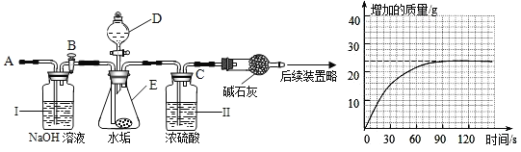
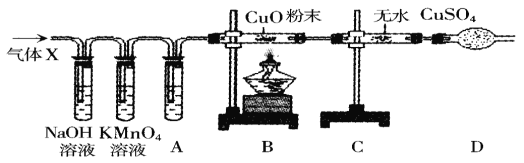
a仪器D、E名称分别是_____、_____;若要检查盛放浓硫酸洗气瓶双孔塞上导气管与橡皮塞接触地方(即上图装置中C处)是否漏气,应在装药品之_____(填“前”或“后”)。
检查,请写出检查C处是否漏气方法:_____。
b步骤①所加酸溶液是_____;请写出中难溶性物质与酸反应化学方程式:_____、_____;
c装置Ⅱ作用是_____;从导管A处缓缓鼓入一定量空气时,装置Ⅰ作用是_____。
d研究性同学通过简单计算,认为中一定含有MgCO3,理由是_____。
(实验结论)通过上述可知:水垢的主要成分有_____。