题目内容
【题目】请你参与某学习小组进行研究性学习的过程,并协助完成相关任务。
(研究课题)探究热水壶底部水垢的主要成分。
(查阅资料)该同学通过查阅资料知道,天然水中一般都含有Ca2+、Mg2+、HCO3-等离子,在加热时,这些离子趋于生成溶解度更小物质-(为碳酸盐、碱等混合物),中一定含有Mg(OH)2和CaCO3同时,他们还查阅到下列有关物质溶解性:
物质 | Ca(HCO3)2 | Mg(HCO3)2 | Ca(OH)2 | Mg(OH)2 | CaCO3 | MgCO3 |
溶解性 | 可溶 | 可溶 | 微溶 | 不溶 | 不溶 | 微溶 |
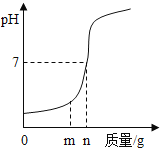
(提出猜想)除一定含有Mg(OH)2和CaCO3之外,还可能含有Ca(OH)2和_____
(设计方案)
(1)甲同学在烧杯中放入少量研碎,加入适量蒸馏水充分搅拌,取上层清液加入Na2CO3溶液,没有白色沉淀,说明中无Ca(OH)2;
(2)乙同学设计下列实验装置,进一步确定水垢中含有碳酸盐成分,步骤如下:
①按图组装仪器,将50g试样放入锥形瓶中,加入足量酸溶液;
②测量一定时间内干燥管内物质增加质量(见下列曲线);
③待锥形瓶中不再产生气泡时,打开活塞B,从导管A处缓缓鼓入一定量空气;
④再次称量干燥管内物质增加质量;
⑤重复③和④操作,直至干燥管内物质质量不变
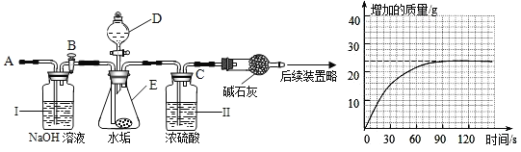
a仪器D、E名称分别是_____、_____;若要检查盛放浓硫酸洗气瓶双孔塞上导气管与橡皮塞接触地方(即上图装置中C处)是否漏气,应在装药品之_____(填“前”或“后”)。
检查,请写出检查C处是否漏气方法:_____。
b步骤①所加酸溶液是_____;请写出中难溶性物质与酸反应化学方程式:_____、_____;
c装置Ⅱ作用是_____;从导管A处缓缓鼓入一定量空气时,装置Ⅰ作用是_____。
d研究性同学通过简单计算,认为中一定含有MgCO3,理由是_____。
(实验结论)通过上述可知:水垢的主要成分有_____。
【答案】MgCO3 分液漏斗 锥形瓶 前 在C处导气管周围滴少量水,关闭B活塞和分液漏斗的活塞,将干燥管左边橡皮管用弹簧夹夹紧,用热毛巾捂锥形瓶,若C处有气泡冒出,说明C处漏气,若C处没有气泡冒出,说明C处不漏气; 稀盐酸 ![]()
![]() 吸收混在二氧化碳气体中的水 除去空气中的二氧化碳 水垢完全反应放出二氧化碳的质量为24g>22g;根据碳酸钙、碳酸镁与盐酸反应放出二氧化碳的关系:等质量的碳酸镁与酸反应放出气体质量大于碳酸钙,因此,水垢中应含有碳酸镁; Mg(OH)2、CaCO3、MgCO3
吸收混在二氧化碳气体中的水 除去空气中的二氧化碳 水垢完全反应放出二氧化碳的质量为24g>22g;根据碳酸钙、碳酸镁与盐酸反应放出二氧化碳的关系:等质量的碳酸镁与酸反应放出气体质量大于碳酸钙,因此,水垢中应含有碳酸镁; Mg(OH)2、CaCO3、MgCO3
【解析】
[提出猜想]
碳酸镁微溶于水,因此水垢中可能含有碳酸镁;
[设计方案]
(1)由溶解性表,要检查氢氧化钙是否存在,可利用向溶液中滴加碳酸钠溶液的方法,因为观察到反应没有出现白色沉淀,所以判断氢氧化钙不存在;
(2)a.仪器D为添加液体药品的分液漏斗;而装置E用作反应容器的锥形瓶;在向装置中加入药品进行实验前,要检查装置的气密性;装置漏气主要是出现仪器连接处,因此在C处导气管周围滴少量水,关闭B活塞和分液漏斗的活塞,将干燥管左边橡皮管用弹簧夹夹紧,用热毛巾捂锥形瓶,若C处有气泡冒出,说明C处漏气,若C处没有气泡冒出,说明C处不漏气;
b.由于碳酸钙与硫酸反应生成微溶于水的硫酸钙会造成反应中止,因此在选择酸时应选择稀盐酸;盐酸与氢氧化镁发生中和反应生成氯化镁和水,碳酸钙与盐酸发生复分解反应生成氯化钙、水和二氧化碳,因此水垢中难溶性物质与酸反应的化学方程式为: ![]() 、
、![]() ;
;
c.装置II中盛放的浓硫酸具有吸水性,在整个装置中起到吸收混在二氧化碳气体中的水的作用;装置I中盛放氢氧化钠溶液,可吸收空气中的二氧化碳,以除去空气中的二氧化碳,防止对后面测定的影响;
d.设50g碳酸钙完全反应生成二氧化碳气体质量为x
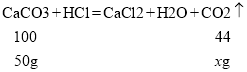
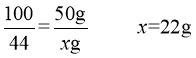
而根据反应记录图,水垢完全反应放出二氧化碳的质量为24g>22g;根据碳酸钙、碳酸镁与盐酸反应放出二氧化碳的关系:等质量的碳酸镁与酸反应放出气体质量大于碳酸钙,因此,水垢中应含有碳酸镁;
[实验结论]
根据资料:水垢中一定含有Mg(OH)2和CaCO3;根据放出二氧化碳的质量为24g的实验数据,通过计算可判断水垢中一定含有碳酸镁;故水垢中含有Mg(OH)2、CaCO3、MgCO3三种物质。

【题目】某同学想在实验室里用NaOH溶液制取Na2CO3溶液。
查阅资料:①CO2通入NaOH溶液时极易因CO2过量而产生NaHCO3,且无明显现象
②NaHCO3溶液煮沸时不会发生分解
③![]()
④Ca(HCO3)2可溶于水
制取步骤:①量取两份50mL相同浓度的NaOH溶液备用;
②用一份50mLNaOH溶液吸收过量的CO2气体,至CO2气体不再溶解;
③小心煮沸②溶液1~2分钟;
④_____,即得Na2CO3溶液。
实验探究:为了检验制得的溶液是否为纯净的Na2CO3溶液,请你与该同学一起完成下列实验探究:
实验步骤 | 实验现象 | 实验结论 | |
取少量制得的溶液于试管中,加入过量的_____溶液 | 产生白色沉淀 | 原来溶液含有Na2CO3 | |
将上步实验所得混合物进行过滤,将滤液分成两份 | 取其中一份加入足量的_____ | 无气泡产生 | 原来制得的溶液中不含_____ |
取另一份加入MgCl2溶液 | _____ | 原来制得的溶液中不含NaOH | |
结论:所制得的溶液为纯净的Na2CO3溶液
评价与反思:有人认为实验步骤③④的顺序对调,即先混合,再煮沸,更合理。你认为对吗?_____请说明理由:_____。
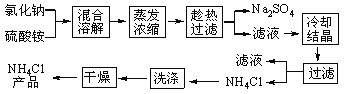
【题目】我国著名化学家侯德榜先生发明了“侯氏制碱法”,其原理中重要的一步是向饱和食盐水中先后通入足量NH3和CO2制备NaHCO3,化学方程式:NaCl+ NH3+CO2+H2O= NaHCO3↓+NH4Cl
某兴趣小组在实验室模拟该过程,请结合具体的步骤回答下列问题:
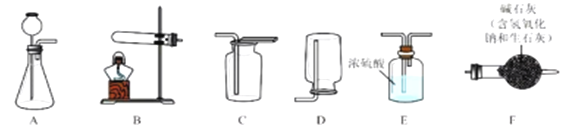
I.气体制备
(1)二氧化碳气体制备
实验室常采用石灰石与稀盐酸反应制备CO2,其化学方程式为_____________。应选择的气体收集装置为______(选填装置对应的字母)。
(2)氨气制备
实验室常用硫酸吸收氨气,防止污染空气,实验室制备NH3的反应原理为:Ca(OH)2(固)+2NH4Cl(固) ![]() CaCl2+2H2O+2NH3↑。现要制备并干燥NH3,所选装置的正确连接顺序为_____→______(选择装置对应的字母)。实验室制备O2也可用上述制备NH3的发生装置,写出用该发生装置制备O2的化学方程式__________。
CaCl2+2H2O+2NH3↑。现要制备并干燥NH3,所选装置的正确连接顺序为_____→______(选择装置对应的字母)。实验室制备O2也可用上述制备NH3的发生装置,写出用该发生装置制备O2的化学方程式__________。
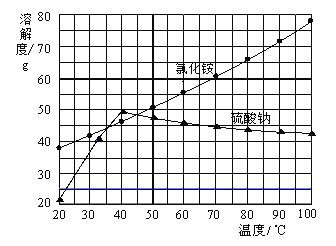
II.NaHCO3制备
物质 | NaHCO3 | NH4Cl |
溶解度/g(20℃) | 9.6 | 37.2 |
(3)根据表格中的溶解度数据,解释20℃产物中NaHCO3能够先从溶液中结晶析出的原因________。
(4)该过程中另一产物NH4Cl在农业生产中常被用作______________。