题目内容
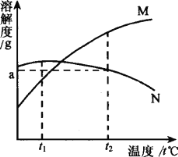
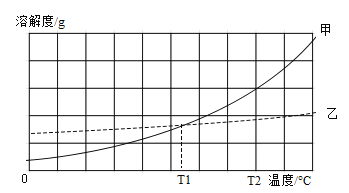
【题目】铬(Cr)是一种重要的金属元素,铬的单质及其化合物应用广泛。重铬酸钾(K2Cr2O7)、NaCl两种物质的溶解度曲线甲、乙如图所示
(1)不锈钢通常含铬,不锈钢比钢有更好的______性能
(2)铬桶可以盛装AlC13溶液,不能盛装稀硫酸,则金属活动性Cr____Al(填“>”或“<”)
(3)不能证明Zn和Cr的活动性强弱的试剂组是__A Zn、Cr和CuSO4溶液 B Cr、ZnSO4溶液
(4)图中_______(填“甲”或“乙”)代表重铬酸钾的溶解度曲线。
(5)T2时,分别将甲、乙的饱和溶液降温至T1,得到两种溶液的溶质质量分数关系为甲_____乙(填“>”或“=”或“<”)
【答案】防腐蚀 < A 甲 =
【解析】
(1)不锈钢耐腐蚀,不锈钢比钢有更好的防腐蚀性能。
(2)铬桶可以盛装AlC13溶液,说明铬与氯化铝不反应,故金属活动性:Al >Cr,不能盛装稀硫酸,说明铬能与稀硫酸反应,金属活动性:Cr>H,即金属活动性H <Cr<Al,故Cr<Al。
(3)要证明两种金属的活动性顺序,可以是一种金属单质与一种金属化合物的水溶液。A 、锌、铬都能与硫酸铜反应,有红色固体析出,说明锌、铬比铜活泼,但是不能证明Zn和Cr的活动性强弱,此选项符合题意;B 、可通过Cr和ZnSO4溶液是否反应来证明Zn和Cr的活动性强弱,如果锌能与硫酸铬反应,说明锌比铬活泼,如果不能反应,说明铬比锌活泼,可以证明两者的金属活动性顺序,此选项不符合题意。故选A。
(4)因为氯化钠的溶解度受温度影响不大,乙代表氯化钠,故图中甲代表重铬酸钾的溶解度曲线。
(5) 甲、乙的溶解度都随温度的升高而增大,T2时,分别将甲、乙的饱和溶液降温至T1,都有晶体析出,都为饱和溶液。由于T1时两种物质的溶解度相等,故降温至T1得到两种溶液的溶质质量分数关系为甲=乙。

 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案【题目】某同学想在实验室里用NaOH溶液制取Na2CO3溶液。
查阅资料:①CO2通入NaOH溶液时极易因CO2过量而产生NaHCO3,且无明显现象
②NaHCO3溶液煮沸时不会发生分解
③![]()
④Ca(HCO3)2可溶于水
制取步骤:①量取两份50mL相同浓度的NaOH溶液备用;
②用一份50mLNaOH溶液吸收过量的CO2气体,至CO2气体不再溶解;
③小心煮沸②溶液1~2分钟;
④_____,即得Na2CO3溶液。
实验探究:为了检验制得的溶液是否为纯净的Na2CO3溶液,请你与该同学一起完成下列实验探究:
实验步骤 | 实验现象 | 实验结论 | |
取少量制得的溶液于试管中,加入过量的_____溶液 | 产生白色沉淀 | 原来溶液含有Na2CO3 | |
将上步实验所得混合物进行过滤,将滤液分成两份 | 取其中一份加入足量的_____ | 无气泡产生 | 原来制得的溶液中不含_____ |
取另一份加入MgCl2溶液 | _____ | 原来制得的溶液中不含NaOH | |
结论:所制得的溶液为纯净的Na2CO3溶液
评价与反思:有人认为实验步骤③④的顺序对调,即先混合,再煮沸,更合理。你认为对吗?_____请说明理由:_____。