题目内容
【题目】(1)水是重要的自然资源。
①有关水的说法正确的是_____。
A 水是由氢元素和氧元素组成 B 水是由氢原子和氧原子构成
C 保持水化学性质的最小粒子是水分子 D 自然界的水都是纯净物
②如图为自来水厂净水过程示意图:
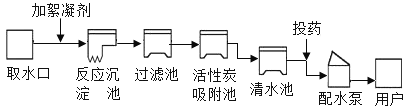
a.试剂X是_____(填名称)。
b.自来水厂的净水过程发生化学变化的一步操作是_____,经过净化操作后得到的水是硬水,鉴别硬水和软水的方法用___________,生活中将硬水转化为软水的方法是_____。
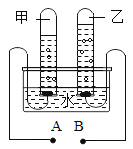
③如图是水电解实验示意图。反应的化学方程式是____________该实验中A连接电源的________极。乙管中收集的气体是______
【答案】AC 活性炭 投药消毒 肥皂水 煮沸 2H2O![]() 2H2↑+O2↑ 负 O2
2H2↑+O2↑ 负 O2
【解析】
(1)①A、水是由氢元素和氧元素组成,正确;
B、1个水分子是由2个氢原子和1个氧原子构成,故错误;
C、由分子构成的物质,分子是保持物质化学性质的最小微粒,保持水化学性质的最小粒子是水分子,正确;
D、自然界的水中含有可溶性的钙镁化合物和气体物质,故都是混合物,故错误;故选AC。
②a、吸附池中加入的物质是活性炭。
b.自来水厂的净水过程发生化学变化的一步操作是杀菌消毒;区别软硬水的方法是向水中加入肥皂水,如泡沫多浮渣少是软水,反之是硬水。煮沸可以将水中可溶性的钙镁化合物转化为难溶性的钙镁化合物,可以降低水的硬度。
③水在通电的条件下分解生成氢气和氧气,反应的方程式为:2H2O![]() 2H2↑+O2↑。甲管中的气体的体积是乙管中的气体体积的2倍,故甲管中是氢气,乙管中是氧气,负极产生的氢气,正极产生的是氧气。故A是负极,乙管中收集的气体是氧气。
2H2↑+O2↑。甲管中的气体的体积是乙管中的气体体积的2倍,故甲管中是氢气,乙管中是氧气,负极产生的氢气,正极产生的是氧气。故A是负极,乙管中收集的气体是氧气。

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案【题目】某兴趣小组对蜡烛燃烧火焰的焰心进行了以下探究.
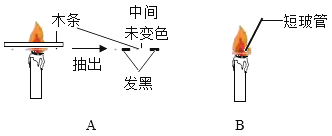
(1)点燃蜡烛,将一根小木条迅速平放入火焰中,约1s后取出,现象如图A,这证明焰心_____.
(2)向焰心处斜向插入一支短玻璃管,发现玻璃管中无明显现象(如图B),在玻璃管的上口点燃,上口产生火焰,这说明焰心物质的性质是:_____(物理性质)、_____(化学性质).
(3)猜想和验证.
猜想 | 操作 | 现象 | 结论 |
假设①:焰心气体含二氧化碳 | 在未点燃的短玻璃管上口_____ | _____ | 假设①不成立 |
假设②:焰心气体含石蜡蒸汽 | 取一较长的细玻璃管,用湿冷毛巾包住中部,将玻璃管下端插入焰心,上端试用火焰点燃 | ______ | 假设②成立 |
取下长玻璃管,打开湿毛巾 | ______ |
(4)若蜡烛的主要成分是石蜡,则其燃烧的反应文字表达式为_________________.
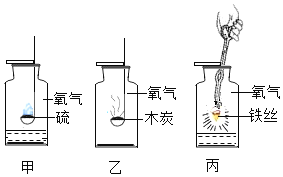
【题目】化学是一门以实验为基础的科学,某同学在实验室利用以下装置制备氧气并探究氧气的性质。请你和该同学一起完成相关实验内容。
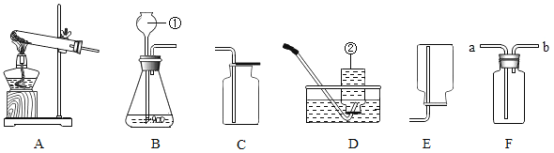
(1)写出图中有标号仪器的名称:①________;②_________。
(2)若用双氧水和二氧化锰制取氧气时应选用_______(填字母标号,下同)发生装置,写出该反应的符号表达式________,二氧化锰在反应中起_____作用。
(3)若用高锰酸钾制取氧气,写出该反应的符号表达式_______,下列是高锰酸钾制氧气的部分操作示意图中,不正确的是_______。
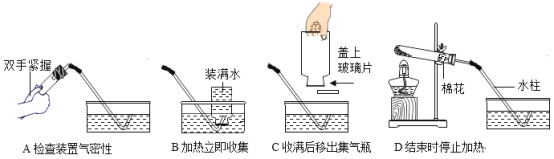
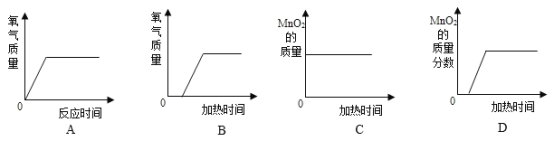
(4)用高锰酸钾制取氧气时,实验数据的变化与下列图像相符合的是________。
(5)若用图F装置收集氧气,检验氧气已收集满的方法是_______。
(6)实验室常用氯化铵固体与熟石灰固体共热来制取氨气。常温下NH3是一种无色、有刺激性气味的气体,则制取NH3,应该选择的发生装置______(填字母标号); 收集NH3,可用装置E,但不能用装置D,由此可知氨气的物理性质有________、________。
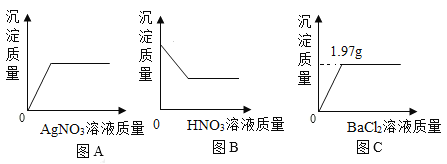
(7)某同学为研究MnO2粉末用量对双氧水分解速率的影响,做了以下实验:采用不同质量的MnO2粉末做催化剂,每次均用30mL 10%的双氧水(其他实验条件均相同),测定收集500mL氧气所用的时间,结果如表:
序号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
MnO2用量/g | 0.1 | 0.2 | 0.3 | 0.4 | 0.5 | 0.6 | 0.7 | 0.8 | 0.9 |
所用时间/s | 17 | 8 | 6 | 3 | 2 | 2 | 2 | 2 | 2 |
①本实验中最好采用____________收集氧气(选填“向上排空气法”或“排水法”)。
②该实验可得出的结论是_____________。
【题目】元素周期表是学习和研究化学的重要工具,它的内容十分丰富。下表是元素周期表的部分内容,请认真分析并回答后面的问题:
IA | 0 | |||||||
1 | 1 H 氢 1.008 | 2 He 氦 4.003 | ||||||
IIA | IIIA | IVA | VA | VIA | VIIA | |||
2 | 3 Li 锂 6.941 | 4 Be 铍 9.012 | 5 B 硼 10.81 | 6 C 碳 12.01 | 7 N 氮 14.01 | 8 O 氧 16.00 | 9 F 氟 19.00 | 10 Ne 氖 20.18 |
3 | 11 Na 钠 22.99 | 12 Mg 镁 24.31 | 13 Al 铝 26.98 | 14 Si 硅 28.09 | 15 P 磷 30.97 | 16 S 硫 32.06 | 17 Cl 氯 35.45 | 18 Ar 氩 39.95 |
(1)很多科学家对元素周期表的发现和完善做出了重大贡献,请写出其中一位科学家的名字:_________。
(2)请从上表中查出地壳中含量最多的金属元素的相对原子质量为__________。
(3)表中不同种元素最本质的区别是_________(填序号):
A相对原子质量不同 B质子数不同 C中子数不同
(4)元素周期表中每一个横行叫做一个周期,通过分析,同一周期元素之间的排列有一定的规律,如:__________(填字母序号)、……
A从左到右,各元素原子的电子层数相同
B从左到右,各元素原子的原子序数依次增加
C从左到右,各元素原子的最外层电子数相同
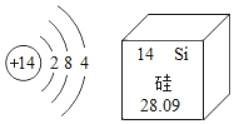
(5)元素周期表中,原子序数为12的镁元素的原子结构示意图如图,该原子在化学反应中易_________(填“得到”或“失去”)电子。说明元素的化学性质与原子的_______关系密切。