题目内容
【题目】现有一瓶不纯的K2CO3粉末,所含杂质可能是KNO3、Ca(NO3)2、KCl、CuCl2、Na2CO3中的一种或几种,为确定其成分,进行如下实验:
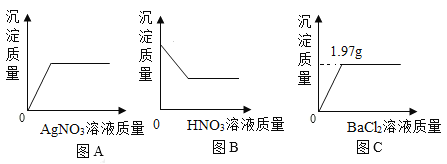
(1)取少量该粉末于烧杯中,加入适量蒸馏水,充分搅拌,得到无色溶液。然后滴加AgNO3溶液,烧杯中沉淀质量变化情况见图A。
(2)再向烧杯中加入足量的稀HNO3,烧杯中沉淀质量变化情况见图B。
(3)另称取1.38g该粉末于烧杯中,加入蒸馏水溶解,再加入足量的BaCl2溶液,烧杯中产生沉淀质量情况见图C。
下列说法正确的是( )
A.杂质中可能含有KNO3、Na2CO3
B.杂质中肯定不含有Ca(NO3)2、CuCl2、Na2CO3
C.杂质中肯定含有KCl,可能含有Na2CO3
D.杂质中肯定含有KCl、Na2CO3,可能含有KNO3
【答案】D
【解析】
取少量该粉末于烧杯中,加入适量蒸馏水,充分搅拌,得无色澄清溶液,说明粉末中不含有硝酸钙和氯化铜,这是因为硝酸钙能和碳酸钾反应生成白色沉淀碳酸钙,含有铜离子的溶液是蓝色溶液;取上述无色溶液少许于试管中,滴加AgNO3溶液有沉淀生成,再加入足量的稀HNO3溶液,沉淀部分溶解,说明粉末中一定含有氯化钾和碳酸钾,这是因为氯化钾能和硝酸银反应生成不溶于稀硝酸的白色沉淀氯化银,可能含有碳酸钠,这是因为碳酸钾、碳酸钠都能够和硝酸银反应生成碳酸银沉淀,碳酸银沉淀溶于稀硝酸。再根据1.38g碳酸钾和足量的氯化钡反应生成1.97g碳酸钡沉淀,1.06g碳酸钠和足量的氯化钡反应生成1.97g碳酸钡沉淀,称取1.38g该粉末于烧杯中,加入蒸馏水溶解,再加入足量的BaCl2溶液,充分反应后生成1.97g白色沉淀,因为粉末中一定含有碳酸钾和氯化钾,碳酸钾质量小于1.38g,和氯化钡反应生成的碳酸钡质量小于1.97g,因此粉末中一定还含有碳酸钠。
A、由上分析可知杂质中可能含有KNO3,一定含有Na2CO3,该选项说法不正确;
B、由上分析可知杂质中肯定不含有Ca(NO3)2、 CuCl2,一定含有Na2CO3,该选项说法不正确;
C、杂质中肯定含有KCl和Na2CO3,该选项说法不正确;
D、由以上分析可知,杂质中肯定含有KCl、Na2CO3,可能含有KNO3。
故选:D。

 全能测控期末小状元系列答案
全能测控期末小状元系列答案【题目】小雨阅读课外资料得知:氯酸钾的分解可用二氧化锰、氧化铜等物质作催化剂。于是,他对影响氯酸钾分解的因素及催化剂的催化效果产生了探究兴趣。
(提出问题)氧化铜是否比二氧化锰催化效果更好?影响氯酸钾分解速率的因素有哪些呢?
(设计实验)小雨以生成等体积的氧气为标准,设计了下列几组实验。
序号 | KClO3的质量 | 其他物质的质量 | 温度 | 氧气的体积 | 反应所需时间 |
① | 10.0 g | 330 ℃ | 100 mL | t1 | |
② | 10.0 g | CuO 1.5 g | 330 ℃ | 100 mL | t2 |
③ | 10.0 g | MnO2 1.5 g | 330 ℃ | 100 mL | t3 |
④ | 10.0 g | MnO2___g | 380 ℃ | 100 mL | t4 |
(1)若t1>t2,说明氧化铜能加快氯酸钾的分解速率。若要确定氧化铜是此反应的催化剂,还需探究反应前后,氧化铜的___________和____________不变。
(2)写出实验④所涉及的化学反应的文字表达式_______。
(3)实验④中MnO2的质量为_________g,若t3>t4,则化学反应快慢与温度的关系是_____。
(4)氯酸钾的分解速率可能还与_____________因素有关。