题目内容
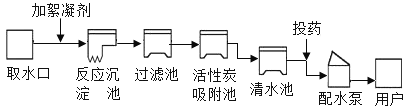
【题目】威海是美丽的海滨城市,有较长的海岸线,海洋资源十分丰富。海水中含有丰富的镁元素,日前工业上绝大多数金属镁是从海水中提取的,其生产流程如下:

①步骤一中发生反应的化学方程式为__________________,________________.
②上述生产流程中发生的反应,写出发生中和反应的方程式_________________.
③在步骤一中分离出沉淀A的方法是________,需要的玻璃仪器有_________________。
④从海水里提取MgCl2时,经历了“MgCl2—Mg(OH)2—MgCl2”的转化过程,这样做的目的是_________。
⑤海水淡化常用_______法和______法,它们的原理分别为_______________和 _____________。
【答案】CaO+H2O=Ca(OH)2 MgCl2 +Ca(OH)2 =Mg(OH)2↓+CaCl2 Mg(OH)2+2HCl = MgCl2+2H2O 过滤 烧杯、玻璃棒、漏斗 为了将MgCl2聚集起来,获得比较纯净的MgCl2 蒸馏 海水淡化膜过滤 利用不同物质的沸点不同 过滤
【解析】
①生石灰是氧化钙的俗称,氧化钙与水反应生成氢氧化钙,由于海水中含有氯化镁,故步骤一中发生反应的化学方程式为:CaO+H2O=Ca(OH)2,MgCl2 +Ca(OH)2 =Mg(OH)2↓+CaCl2。
②中和反应是酸碱之间的反应,沉淀A是氢氧化镁,故上述生产流程中发生中和反应的方程式为:Mg(OH)2+2HCl=MgCl2+2H2O
③通过过滤可将难溶于水的固体物质与液体分离,在步骤一中分离出沉淀A的方法是过滤,过滤操作中需要的玻璃仪器有烧杯、玻璃棒、漏斗。
④从海水里提取MgCl2时,经历了“MgCl2—Mg(OH)2—MgCl2”的转化过程,这样做的目的是为了将MgCl2聚集起来,获得比较纯净的MgCl2。
⑤海水淡化常用蒸馏法和海水淡化膜过滤法,它们的原理分别为利用不同物质的沸点不同和过滤。

 字词句段篇系列答案
字词句段篇系列答案【题目】实验室有一瓶保管不当的试剂(如下图),其残缺的标签中只剩下“Na”和“10%”的字样。已知它是无色液体,是初中化学常用的试剂。小欣和小芳同学很感兴趣,决定对其成分进行探究。

(提出猜想)
(1)这瓶试剂可能是什么溶液呢? ____
①可能是NaOH溶液; ②可能是Na2CO3溶液; ③可能是NaCl溶液。
(2)根据受损标签的情况判断,这瓶试剂不可能是____ (填字母代号)。
A酸 B碱 C盐
(收集资料)Ⅰ.初中化学常见的含钠化合物有NaCl、NaOH、Na2CO3、NaHCO3。
Ⅱ.测定室温(20 ℃)时,四种物质的溶解度的数据如下:
物质 | NaCl | NaOH | Na2CO3 | NaHCO3 |
溶解度/g | 36 | 109 | 215 | 9.6 |
(得出结论)
(3)小欣根据试剂瓶标注的溶质质量分数10%和上表中的溶解度的数据判断,这瓶试剂不可能是_________。
(设计实验)
(4)①小芳用胶头滴管吸取该溶液滴在pH试纸上,测得pH>7,这瓶试剂不可能是___。
②小欣为了检验该溶液是NaOH溶液还是Na2CO3溶液,她又进行了如下实验:
操作步骤 | 实验现象 | 结论及化学方程式 |
取样于试管中,滴加氢氧化钙溶液 | ___ | 猜想②正确,相关的化学方程式:_____ |
(5)请你选择与小欣不同类别的试剂,来鉴别NaOH溶液和Na2CO3溶液,你选择_______溶液。