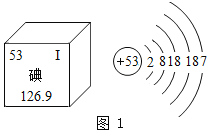
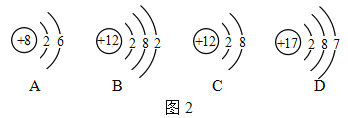
题目内容
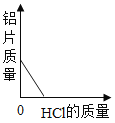
【题目】某化学兴趣小组的同学想从含有Al2(SO4)3、CuSO4的废液中回收金属铜,设计流程如图:

(1)I中有关反应的化学方程式为__________。
(2)溶液B中所含的溶质是__________(填化学式)。
(3)过程I、Ⅱ中涉及反应的基本类型均为_________。
(4)Ⅱ中加入过量稀硫酸的目的是_________。
【答案】Fe+CuSO4=FeSO4+Cu Al2(SO4)3、FeSO4 置换反应 除尽固体A中的铁
【解析】
(1)Al2(SO4)3、CuSO4的废液中加入过量铁粉,铁粉只与CuSO4反应,生成硫酸亚铁和铜,故填写:Fe+CuSO4=FeSO4+Cu;
(2)由图可知,溶液B是废液与过量铁粉反应后,过滤形成的溶液,由于铁的金属活动性比铝弱,因此,铁粉不与Al2(SO4)3反应,溶液B溶质中一定含有Al2(SO4)3,而铁粉与硫酸铜反应,生成物中硫酸亚铁,所以,溶液B溶质中一定含有FeSO4,故填写:Al2(SO4)3、FeSO4;
(3)I反应是铁与硫酸铜反应生成硫酸亚铁和铜,过程Ⅱ中过量的稀硫酸与剩余的铁粉反应,生成硫酸亚铁和氢气,两者都是单质与化合物反应,生成另一种单质和另一种化合物,符合置换反应的定义,故填写:置换反应;
(4)由图可知,过程I中加入了过量的铁粉,因此,Ⅱ中加入过量稀硫酸的目的是除尽固体A中的铁,故填写:除尽固体A中的铁。

 名校课堂系列答案
名校课堂系列答案【题目】研究金属的腐蚀对资源的利用和保护意义重大。
(1)为了探究铁锈蚀的条件,进行如图-12所示实验。经过一周后观察,试管A和C中的铁钉无明显变化,试管B中的铁钉明显锈蚀。
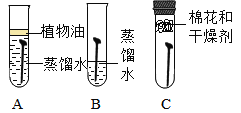
①通过实验发现:铁锈蚀是铁与_____________发生化学反应的过程。
② A中加入的蒸馏水要事先煮沸,其目的是______________________。
(2)家中的刀具若沾有食盐水锈蚀更快。为了进一步探究影响铁锈蚀速率的因素,做了如下的实验。
(提出问题)铁锈蚀速率与哪些因素有关。
(查阅资料)①物质溶解在水中得到的混合物称为水溶液,如氯化钠溶解在水中得到氯化钠溶液,乙醇溶解在水中得到乙醇溶液。
②氯化钠溶液能导电;乙醇溶液不能导电。
(猜想)铁的锈蚀速率与下列因素有关:
①反应时的温度;②氧气的含量;③水溶液的导电性。
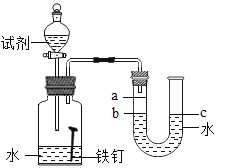
(实验)每次取两套如图-13所示的装置,编号为I、II。向两套装置中分别装入质量、大小相同的铁钉和等体积的蒸馏水,进行如下三组对比实验(实验开始时,各瓶内气体压强保持一致)。
影响因素 | 实验设计 | 实验现象 | 实验结论及解释 |
①温度 | 装置I放入25℃恒温环境中,装置II放入40℃恒温环境中。 | 两套装置中铁钉均锈蚀,且U型管中液面均由b处上升至a处,则所需时间I>II。 | 锈蚀的速率I<II;铁的锈蚀速率与反应时的温度有关,_。 |
②氧气含量 |
|
| 铁的锈蚀速率与氧气的含量有关,氧气的含量越多,铁的锈蚀越快。 |
③水溶液的导电性 | 在相同温度下,装置I集气瓶中加入10mL氯化钠溶液;装置II集气瓶中加入10mL乙醇。 | 两套装置中铁钉均锈蚀; |
|
(3)若将两根铁钉分别放入两支试管中,在一支试管中加入稀硫酸,另一支试管中加入稀盐酸,观察到两支试管内均有大量气泡产生,铁钉逐渐溶解,在酸溶液中被快速腐蚀。
(反思与提高)
根据该探究实验以及你所学的知识,判断下列说法正确的是________(填序号)。
A金属的腐蚀是指金属单质与其它物质发生化学反应的过程[
B金属越活泼,就越容易被锈蚀
C金属腐蚀不一定要有氧气参加