题目内容
【题目】碳酸氢钠是小苏打的主要成分,在生产和生活中有许多重要的用途。在化学课上,同学们为了解碳酸氢钠的性质,将一定质量的碳酸氢钠与稀硫酸混合,充分反应后,有气体逸出,该反应的化学方程式为![]() ,同学们对反应后溶液中溶质的成分进行了探究:认为除一定含有硫酸钠外,可能还含有其他成分,因此进行了猜想并做了如下实验:
,同学们对反应后溶液中溶质的成分进行了探究:认为除一定含有硫酸钠外,可能还含有其他成分,因此进行了猜想并做了如下实验:
[实验用品] pH试纸、锌片、氧化铜粉末、稀硫酸、氢氧化钠溶液、氯化钡溶液
[猜想与假设]反应后溶液中溶质的可能组成成分
猜想一:硫酸钠;
猜想二:硫酸钠、碳酸氢钠;
猜想三: 硫酸钠、硫酸
[实验探究]同学们取反应后的物质用不同方案进行如下实验,请根据结论完成下表:
实验方案 | 实验操作 | 实验现象及解释 | 实验结论 |
A | 向反应后的溶液中滴加稀硫酸 | 无气体放出 | 猜想二不正确 |
B | 向反应后的溶液中滴加氯化钡溶液 | 产生白色沉淀, 其反应的化学方程式为_______ | 猜想三正确 |
C | 用镊子取一片pH试纸浸入反应后的溶液中 | 试纸变色,对照标准比色卡,PH___________7 | 猜想三正确 |
D | 向反应后的溶液中加入锌片 | ________ | 猜想三正确 |
[得出结论]猜想三正确。
[评价反思]
(1)老师对同学们能用多种方案进行探究,并且得出正确的实验结论给予了肯定,同时指出探究中存在一处明显的错误操作:_____________。
(2)有同学对实验方案B的结论提出了质疑,认为仅凭此现象不能得出猜想三正确,请说明理由:______。
[总结提高]依据所给实验用品,设计不同的方案确认猜想三是正确的。请写出你的实验方案的化学方程式_______。
【答案】![]() < 锌粒逐渐溶解,有气体放出 将pH试纸浸入溶液中 硫酸钠也能与氯化钡反应生成沉淀
< 锌粒逐渐溶解,有气体放出 将pH试纸浸入溶液中 硫酸钠也能与氯化钡反应生成沉淀 ![]()
【解析】
实验探究:B、根据实验结论:猜想三正确,说明该实验是想验证溶液中是否含有硫酸,故向反应后的溶液中滴加氯化钡溶液,氯化钡和稀硫酸发生反应生成硫酸钡沉淀和盐酸,该反应的化学方程式为:![]() ;
;
C、根据实验结论:猜想三正确,猜想三为:硫酸钠、硫酸,硫酸显酸性,故测得的pH<7;
D、根据实验结论:猜想三正确,猜想三为:硫酸钠、硫酸,因此向反应后的溶液中加入锌片,锌和硫酸反应生成硫酸锌和氢气,实验现象为:锌粒逐渐溶解,有气泡冒出;
评价反思:(1)操作错误为:将pH试纸浸入反应后的溶液中,测定pH值,正确的方法是:用洁净、干燥的玻璃棒蘸取待测液,点在pH试纸上,观察颜色变化,再与标准比色卡对照;
(2)溶液中有硫酸钠,硫酸钠也能与氯化钡反应生成硫酸钡沉淀,故仅凭出现白色沉淀不能得出猜想三正确;
总结提高:要想确认猜想三是正确的,需要证明硫酸的存在,根据所给试剂,可向溶液中加入氧化铜粉末,氧化铜能与硫酸反应生成硫酸铜和水,实验现象为:氧化铜逐渐溶解,溶液颜色变蓝,该反应的化学方程式为:![]() 。
。

 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案【题目】石灰石是重要的矿石之一。学校研究性学习小组为了测定当地矿山石灰石中碳酸钙的质量分数,取来了一些矿石样品,并取稀盐酸200g,平均分成4份,进行实验,结果如下:
实验 | 1 | 2 | 3 | 4 |
加入样品的质量/g | 5 | 10 | 15 | 20 |
生成CO2的质量/g | 1.76 | 3.52 | 4.4 | m |
(1)哪几次反应中矿石中碳酸钙有剩余:________
(2)上表中m的数值是________
(3)试计算出这种石灰石矿中碳酸钙的质量分数________
【题目】酸、碱、盐是有广泛用途的重要化合物。某化学兴趣小组的同学围绕这几类化合物进行了一系列的探究活动。
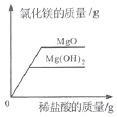
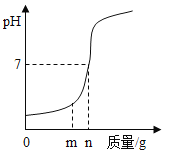
(1)用熟石灰中和一定量的盐酸时,溶液的pH与加入的熟石灰质量的关系如图所示。熟石灰与盐酸反应的化学方程式为_____;当加入熟石灰mg时,溶液中的溶质为_____。
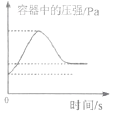
(2)设计的趣味小实验装置如图所示,其中A、B为未膨胀的气球,C为玻璃导管,D为胶头滴管。用气密性良好的该装置分别进行甲、乙两组实验。实验时均把胶头滴管中的溶液(足量)加入到锥形瓶中,并轻轻振荡。请填写下表中的空白:
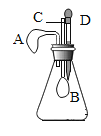
锥形瓶中的物质 | 胶头滴管中的物质 | 观察到气球(A、B)的变化 | 有关反应的化学方程式 | |
甲 | 二氧化碳 | 浓氢氧化钠溶液 | _____ | _____ |
乙 | _____ | _____ | A气球胀大,B气球无明显变化 | _____ |
(3)某工厂实验室用15%的氢氧化钠溶液洗涤一定量石油产品中的残余硫酸,共消耗氢氧化钠溶液40g,洗涤后的溶液呈中性。这一定量石油产品中含H2SO4的质量是多少_____?