题目内容
【题目】酸、碱、盐是有广泛用途的重要化合物。某化学兴趣小组的同学围绕这几类化合物进行了一系列的探究活动。
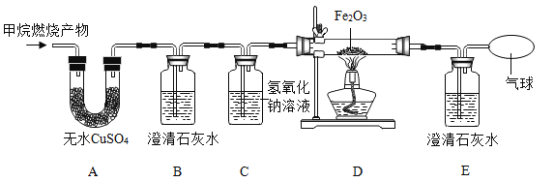
(1)用熟石灰中和一定量的盐酸时,溶液的pH与加入的熟石灰质量的关系如图所示。熟石灰与盐酸反应的化学方程式为_____;当加入熟石灰mg时,溶液中的溶质为_____。
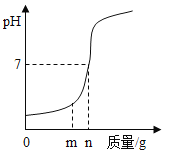
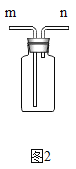
(2)设计的趣味小实验装置如图所示,其中A、B为未膨胀的气球,C为玻璃导管,D为胶头滴管。用气密性良好的该装置分别进行甲、乙两组实验。实验时均把胶头滴管中的溶液(足量)加入到锥形瓶中,并轻轻振荡。请填写下表中的空白:
锥形瓶中的物质 | 胶头滴管中的物质 | 观察到气球(A、B)的变化 | 有关反应的化学方程式 | |
甲 | 二氧化碳 | 浓氢氧化钠溶液 | _____ | _____ |
乙 | _____ | _____ | A气球胀大,B气球无明显变化 | _____ |
(3)某工厂实验室用15%的氢氧化钠溶液洗涤一定量石油产品中的残余硫酸,共消耗氢氧化钠溶液40g,洗涤后的溶液呈中性。这一定量石油产品中含H2SO4的质量是多少_____?
【答案】2HCl+Ca(OH)2=CaCl2+2H2O CaCl2、HCl A气球无明显变化,B气球胀大 CO2+2NaOH=Na2CO3+H2O 二氧化锰 过氧化氢溶液 2H2O2![]() 2H2O+O2↑ 7.35g
2H2O+O2↑ 7.35g
【解析】
(1)氢氧化钙和盐酸反应能生成氯化钙和水,反应的化学方程式为:Ca(OH)2+2HCl=CaCl2+2H2O;当加入熟石灰mg时,溶液的pH小于7,溶液显酸性,盐酸有剩余,溶液中的溶质是盐酸中的氯化氢和反应生成的氯化钙.
故答案为:Ca(OH)2+2HCl=CaCl2+2H2O;CaCl2和HCl;
(2)二氧化碳能与氢氧化钠反应生成碳酸钠和水,气体被消耗从而锥形瓶内的压强变小,故会观察到A气球无明显,B气球胀大,故填:A气球无明显变化,B气球胀大;2NaOH+CO2═Na2CO3+H2O;
A气球胀大,B气球无明显变化,说明锥形瓶内的气压变大,则是物质间反应产生了气体,故锥形瓶内的物质可能是二氧化锰,胶头滴管中的物质是过氧化氢溶液,过氧化氢在二氧化锰的催化作用下反应生成水和氧气,故填:二氧化锰;过氧化氢溶液;2H2O2![]() 2H2O+O2↑;
2H2O+O2↑;
(3)设一定量石油产品中硫酸的质量为x.
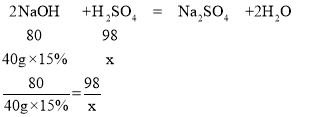
解得x=7.35g.
答:此一定量的石油产品里硫酸的质量是7.35g。

【题目】碳酸氢钠是小苏打的主要成分,在生产和生活中有许多重要的用途。在化学课上,同学们为了解碳酸氢钠的性质,将一定质量的碳酸氢钠与稀硫酸混合,充分反应后,有气体逸出,该反应的化学方程式为![]() ,同学们对反应后溶液中溶质的成分进行了探究:认为除一定含有硫酸钠外,可能还含有其他成分,因此进行了猜想并做了如下实验:
,同学们对反应后溶液中溶质的成分进行了探究:认为除一定含有硫酸钠外,可能还含有其他成分,因此进行了猜想并做了如下实验:
[实验用品] pH试纸、锌片、氧化铜粉末、稀硫酸、氢氧化钠溶液、氯化钡溶液
[猜想与假设]反应后溶液中溶质的可能组成成分
猜想一:硫酸钠;
猜想二:硫酸钠、碳酸氢钠;
猜想三: 硫酸钠、硫酸
[实验探究]同学们取反应后的物质用不同方案进行如下实验,请根据结论完成下表:
实验方案 | 实验操作 | 实验现象及解释 | 实验结论 |
A | 向反应后的溶液中滴加稀硫酸 | 无气体放出 | 猜想二不正确 |
B | 向反应后的溶液中滴加氯化钡溶液 | 产生白色沉淀, 其反应的化学方程式为_______ | 猜想三正确 |
C | 用镊子取一片pH试纸浸入反应后的溶液中 | 试纸变色,对照标准比色卡,PH___________7 | 猜想三正确 |
D | 向反应后的溶液中加入锌片 | ________ | 猜想三正确 |
[得出结论]猜想三正确。
[评价反思]
(1)老师对同学们能用多种方案进行探究,并且得出正确的实验结论给予了肯定,同时指出探究中存在一处明显的错误操作:_____________。
(2)有同学对实验方案B的结论提出了质疑,认为仅凭此现象不能得出猜想三正确,请说明理由:______。
[总结提高]依据所给实验用品,设计不同的方案确认猜想三是正确的。请写出你的实验方案的化学方程式_______。