题目内容
【题目】在化学反应中,物质所含元素的化合价发生了变化的反应就是氧化还原反应。 例:2Na+Cl2═2NaCl,反应前后,Na、Cl的化合价发生了变化,该反应是氧化还原反应。
(1)根据化合价是否变化分析,下列反应不属于氧化还原反应的是(填序号)_____。
A 2Mg+O2![]() 2MgO;
2MgO;
B CaO+H2O=Ca(OH)2
C 2KClO3![]() 2KCl+3O2↑
2KCl+3O2↑
D H2+CuO![]() Cu+H2O
Cu+H2O
(2)含有高价态的化合物,通常具有氧化性,如在氯化铁溶液中,氯化铁能将单质铜氧化成氯化铜,自身被还原成氯化亚铁。试回答:
①该反应的化学方程式可表示为_____。
②向上述反应后的溶液中加入适量的锌粉反应后过滤,向过滤后得到的固体物质上加稀盐酸有气泡产生,则滤纸上一定含有的固体是(写化学式)_____,滤液中的溶质一定含有的是_____。
【答案】B 2FeCl3+Cu═2FeCl2+CuCl2 Cu、Fe ZnCl2
【解析】
(1)A 反应前镁、氧两种元素的化合价均为0,反应后镁元素的化合价为+2价,氧元素的化合价为-2价,反应属于氧化还原反应,选项错误;
B 反应前后各元素的化合价保持不变,所以反应不属于氧化还原反应,选项正确;
C 反应前氯元素的化合价为+5价,氧元素的化合价为-2价,反应后氯元素的化合价为-1价,氧元素的化合价为0,所以反应属于氧化还原反应,选项错误;
D 反应前氢元素的化合价为0,铜元素的化合价为+2价,反应后氢元素的化合价为+1价,铜铜元素的化合价为0,反应属于氧化还原反应,选项错误,故填B。
(2)①该反应是氯化铁和铜反应生成氯化铜和氯化亚铁,故反应的化学方程式写为:2FeCl3+Cu═2FeCl2+CuCl2;
②根据金属活动性可知,锌的活动性既大于铁又大于铜,所以可以置换出来溶液中的铜离子和铁离子,但反应的顺序是先置换出活动性最弱的铜离子,当铜离子被全部还原后才去置换溶液中的铁离子,适量的锌粉说明锌的量不固定,则可说明一定含有的固体是铜,固体物质上加稀盐酸有气泡产生,说明固体中含有能遇酸生成气体的金属,则可判断金属固体中一定有铁,含不含锌由于其量不固定,所以无法确定,所以滤纸上一定含有的固体是铜和铁,其化学式分别为Cu、Fe,故填Cu、Fe;
锌与氯化铜反应生成氯化锌和铜,与氯化亚铁反应生成氯化锌和铁,所以滤液中一定有氯化锌,其化学式为ZnCl2,故填ZnCl2。

【题目】不少家庭养观赏鱼,有时会在鱼缸里放点鱼浮灵,可使水中的含氧量迅速增加,能有效提高鱼的成活率,并且有杀菌作用。某小组对鱼浮灵成份及原理进行了相关探究。
(实验1)检验气体
查阅资料1:鱼浮灵化学名称是过氧碳酸钠(xNa2CO3yH2O2),常温下,过氧碳酸钠易溶于水并迅速放出氧气。
实验方案1::在一支试管中加入适量的鱼浮灵,____________(将后续操作及现象补充完整),证明产生的气体是氧气。
(实验2)检验反应后溶液中的溶质成分
猜想假设:猜想1:Na2CO3 猜想2:Na2CO3和NaOH
查阅资料2:用一定溶质质量分数的NaOH和Na2CO3两种溶液进行如下实验。
NaOH溶液 | Na2CO3溶液 | |
滴加酚酞溶液 | 现象 | 现象 |
加入稀盐酸 | 无明显现象 | 现象 |
加入澄清石灰水 | 无明显现象 | 现象 |
加入 1%的CaCl2溶液 | 溶液变浑浊 | 溶液变浑浊 |
加入 0.1%的CaCl2溶液 | 无明显现象 | 溶液变浑浊 |
表中的现象 _______(填序号)为溶液变红色,现象③对应的化学反应方程式为____。
实验方案 2:同学们取实验 1 反应后的溶液于试管中,加入过量_____(填“1%”或“0.1%”)的 CaCl 2 溶液,充分反应后过滤,取少量滤液,向滤液中滴加无色酚酞溶液,观察到滤液呈 _______色,证明猜想 1 正确。
(反思拓展) 根据上述探究可知,保存鱼浮灵时应注意___________。
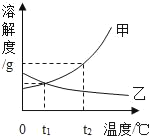
【题目】在一定条件下,甲、乙、丙、丁四种物质在一密闭容器中充分反应,测得反应前后各物质的质量如表所示。根据表中信息判断下列说法正确的是
物 质 | 甲 | 乙 | 丙 | 丁 |
反应前的质量 | 2 | 30 | 20 | 10 |
反应后的质量 | m | 39 | 5 | 16 |
A.该反应是化合反应B.甲一定是该反应的催化剂
C.反应过程中乙、丙变化的质量比为3:5D.丙可能是单质