题目内容
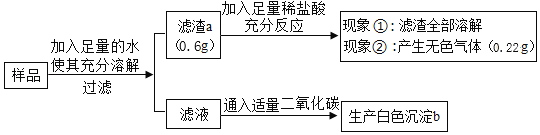
【题目】海水晒盐得到的粗盐中含有少量的![]() 杂质。将粗盐经过如下流程净化制得纯净氯化钠,再通过电解饱和食盐水得到相应的产物。请回答:
杂质。将粗盐经过如下流程净化制得纯净氯化钠,再通过电解饱和食盐水得到相应的产物。请回答:
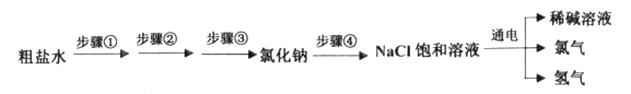
(1)根据所学知识推测,稀碱溶液中的溶质化学式为_____。
(2)在步骤①中除了可以按照![]() 的顺序添加除杂试剂,其中利用氢氧化钠除去杂质的化学反应方程式为_____,除了上述试剂的添加顺序以外,还可以选择的顺序是_____(填字母)。
的顺序添加除杂试剂,其中利用氢氧化钠除去杂质的化学反应方程式为_____,除了上述试剂的添加顺序以外,还可以选择的顺序是_____(填字母)。
A ![]() B
B ![]() C
C ![]()
(3)在步骤②中,滴加稀盐酸的作用是_____
(4)将20℃时l36g氯化钠的饱和溶液(20℃时,氯化钠溶解度为36g)稀释成溶质质量分数为15%的溶液,需要加入水的质量_____g,其主要操作顺序_____(填字母)。
A 计算→量取→混匀→装瓶贴签 B 计算→称量→量取→溶解→装瓶贴签
【答案】![]()
![]() B 除去过量的碳酸钠和氢氧化钠 104 A
B 除去过量的碳酸钠和氢氧化钠 104 A
【解析】
(1)电解饱和的氯化钠溶液生成氢氧化钠、氢气、氯气,所以稀碱溶液中的溶质为氢氧化钠,化学式为NaOH;
(2)利用氢氧化钠和氯化镁反应生成氢氧化镁沉淀而除去镁离子,反应的化学方程为![]() ;去除含有氯化钙、硫酸钠、氯化镁可溶性杂质,根据题意是先加入过量BaCl2(去除硫酸根离子),再加入过量NaOH(去除镁离子),再加入过量Na2CO3(去除钙离子及BaCl2中的钡离子),根据除杂的原理可知加入的各试剂都应过量,且碳酸钠必须在氯化钡的后面,以除去氯化钙和过量的氯化钡,最后利用盐酸除去过量的氢氧化钠和碳酸钠,所以还可以选择氢氧化钠、氯化钡、碳酸钠的顺序或氯化钡、碳酸钠、氢氧化钠的顺序,故填B;
;去除含有氯化钙、硫酸钠、氯化镁可溶性杂质,根据题意是先加入过量BaCl2(去除硫酸根离子),再加入过量NaOH(去除镁离子),再加入过量Na2CO3(去除钙离子及BaCl2中的钡离子),根据除杂的原理可知加入的各试剂都应过量,且碳酸钠必须在氯化钡的后面,以除去氯化钙和过量的氯化钡,最后利用盐酸除去过量的氢氧化钠和碳酸钠,所以还可以选择氢氧化钠、氯化钡、碳酸钠的顺序或氯化钡、碳酸钠、氢氧化钠的顺序,故填B;
(3)在步骤②中,滴加稀盐酸的作用是除去步骤①中过量的氢氧化钠和碳酸钠;
(4)根据20℃时氯化钠的溶解度为36g,可知l36g氯化钠的饱和溶液中溶质质量为36g,溶剂质量为100g,由于稀释前后溶质质量不变,设需要加入水的质量为x,则36g=(136g+x)×15%,x=104g;稀释溶液的主要操作顺序是计算、量取、混匀、装瓶贴签。

 阅读快车系列答案
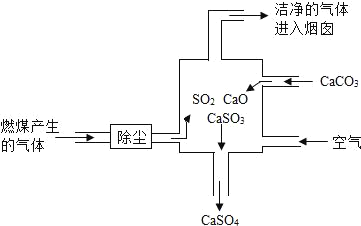
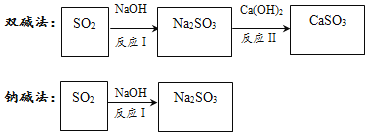
阅读快车系列答案【题目】工业烟气通常含二氧化硫,在排放前需经脱硫处理。如图是两种常用脱硫工艺中含硫物质的转化路径(部分产物已略)。
(1)下列环境问题与SO2有关的是______(填字母序号)。
A 酸雨B 温室效应C 臭氧空洞
(2)双碱法中的“双碱”指的是______(填化学式)。
(3)SO2与NaOH反应的化学方程式为______。
(4)反应II的化学反应基本类型是______反应(选填“化合”“分解”“置换”“复分解”)该反应的化学方程式为______。
(5)已知部分原料的价格如表所示。
试剂 | Ca(OH)2 | NaOH |
价格(元/kg) | 0.36 | 2.90 |
两种工艺中,处理相同量的SO2,应选择的处理方法是______,原因是______。