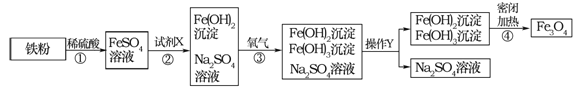
题目内容
【题目】下列说法正确的是( )
A. 等质量的![]() 和
和![]() ,氧元素质量比为5:6
,氧元素质量比为5:6
B. 等质量的![]() 和
和![]() ;混合后,氮元素质量分数大于35%
;混合后,氮元素质量分数大于35%
C. 等质量的水和过氧化氢,完全分解后生成氧气的质量比为17:9
D. 等质量、等质量分数的氢氧化钾溶液和稀盐酸,充分反应后,所得溶液呈碱性
【答案】AC
【解析】
A、设等质量的二氧化硫和三氧化硫的质量均为a,则二氧化硫中含有的氧元素的质量为![]() ,三氧化硫中含有的氧元素质量为
,三氧化硫中含有的氧元素质量为![]() ,则氧元素质量比为
,则氧元素质量比为![]() ∶
∶![]() =5∶6,故选项正确;
=5∶6,故选项正确;
B、硝酸铵中的氮元素质量分数为![]() ,硫酸铵中的氮元素质量分数为
,硫酸铵中的氮元素质量分数为![]() <35%,等质量的硝酸铵和硫酸铵混合后氮元素质量分数一定小于35%,故选项不正确;
<35%,等质量的硝酸铵和硫酸铵混合后氮元素质量分数一定小于35%,故选项不正确;
C、设水和过氧化氢的质量都为b,根据化学方程式

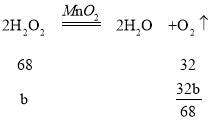
则生成的氧气的质量比为![]() ∶
∶![]() =17∶9, 故选项正确;
=17∶9, 故选项正确;
D、根据氢氧化钾和盐酸反应的质量关系![]() 可知,等质量、等质量分数的氢氧化钾溶液和稀盐酸,充分反应后,盐酸有剩余,所得溶液显酸性,故选项不正确;
可知,等质量、等质量分数的氢氧化钾溶液和稀盐酸,充分反应后,盐酸有剩余,所得溶液显酸性,故选项不正确;
故选AC。

练习册系列答案
 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案
相关题目
【题目】一定条件下,下列物质在密闭容器内充分反应,测得反应前后各物质的质量如下:
纯净物 | 乙醇 | 氧气 | 二氧化碳 | 水 | X |
反应前质量/g | 2.3 | 4 | 0 | 0 | 0 |
反应后质量/g | 0 | 0 | 2.2 | 2.7 | 待测 |
A.反应后X的质量为1.5g B.X中一定含有碳元素和氧元素
C.X中一定含有碳元素和氢元素 D.X中两种元素的质量比是1:1