题目内容
化学兴趣学习小组进行一个有趣的实验探究:测定鸡蛋壳中碳酸钙的质量分数.实验如下:称取5g洁净、干燥的鸡蛋壳放在大试管中.然后往大试管中加入15g稀盐酸,充分反应后,称得反应后剩余物质的质量为18.24g.(假设其它物质不与盐酸反应)请回答:
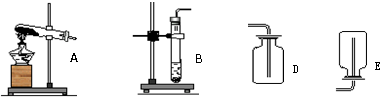
(1)你认为该实验的发生装置应选取上图中的
(2)上述实验中产生二氧化碳的质量为
(3)计算该鸡蛋壳中碳酸钙的质量分数.(要求写出计算过程)

(1)你认为该实验的发生装置应选取上图中的
B
B
(填序号),选取依据是该反应不需要加热
该反应不需要加热
.收集装置应选上图中的D
D
(填序号),检验方法:将生成的气体通入澄清石灰水如果石灰水变浑浊,则可证明该气体是二氧化碳
将生成的气体通入澄清石灰水如果石灰水变浑浊,则可证明该气体是二氧化碳
.验满方法:用燃着的木条伸到集器瓶口,如果木条熄灭,则可证明集气瓶已经充满了二氧化碳
用燃着的木条伸到集器瓶口,如果木条熄灭,则可证明集气瓶已经充满了二氧化碳
.(2)上述实验中产生二氧化碳的质量为
1.76
1.76
g.(3)计算该鸡蛋壳中碳酸钙的质量分数.(要求写出计算过程)
分析:(1)依据实验室制取和手机二氧化碳的有关基本操作分析解答;
(2)依据质量守恒定律利用反应前后物质的质量之差可知生成的二氧化碳的质量;
(3)利用二氧化碳的质量结合化学方程式的有关计算分析解答;
(2)依据质量守恒定律利用反应前后物质的质量之差可知生成的二氧化碳的质量;
(3)利用二氧化碳的质量结合化学方程式的有关计算分析解答;
解答:解:(1)碳酸钙与盐酸反应不需要加热,所以应选择装置B,二氧化碳的密度比空气大,所以应该采用向上排空气法,故收集装置选D,二氧化碳的检验一般采用石灰水完成,可采用将生成的气体通入澄清石灰水如果石灰水变浑浊,则可证明该气体是二氧化碳;验满的方法是用燃着的木条伸到集器瓶口,如果木条熄灭,则可证明集气瓶已经充满了二氧化碳;
(2)依据质量守恒定律可知该反应生成的二氧化铜的质量是5g+15g-18.24g=1.76g
(3)设蛋壳中碳酸钙的质量是x
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
x 1.76g
=
x=4g
故鸡蛋壳中碳酸钙的质量分数为
×100%=80%
故答案为::(1)B;该反应不需要加热;D;将生成的气体通入澄清石灰水如果石灰水变浑浊,则可证明该气体是二氧化碳;用燃着的木条伸到集器瓶口,如果木条熄灭,则可证明集气瓶已经充满了二氧化碳;
(2)1.76;
(3)故鸡蛋壳中碳酸钙的质量分数为80%;
(2)依据质量守恒定律可知该反应生成的二氧化铜的质量是5g+15g-18.24g=1.76g
(3)设蛋壳中碳酸钙的质量是x
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
x 1.76g
| 100 |
| x |
| 44 |
| 1.76g |
x=4g
故鸡蛋壳中碳酸钙的质量分数为
| 4g |
| 5g |
故答案为::(1)B;该反应不需要加热;D;将生成的气体通入澄清石灰水如果石灰水变浑浊,则可证明该气体是二氧化碳;用燃着的木条伸到集器瓶口,如果木条熄灭,则可证明集气瓶已经充满了二氧化碳;
(2)1.76;
(3)故鸡蛋壳中碳酸钙的质量分数为80%;
点评:利用质量守恒定律求出反应放出二氧化碳的质量,是进行后面计算的基础,体现出运用知识分析问题的能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
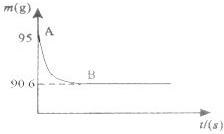 化学陈老师指导某化学兴趣学习小组进行了一个有趣的实验探究:测定鸡蛋壳的主要成分碳酸钙的质量分数.现取15g鸡蛋壳,捣碎,放在烧杯中,然后向其中加入80g稀盐酸,使之恰好完全反应(鸡蛋壳中杂质不与稀盐酸反应),测得烧杯中的反应剩余物的质量(m)与反应时间(t)的关系如图所示(忽略水蒸气的挥发),试计算:
化学陈老师指导某化学兴趣学习小组进行了一个有趣的实验探究:测定鸡蛋壳的主要成分碳酸钙的质量分数.现取15g鸡蛋壳,捣碎,放在烧杯中,然后向其中加入80g稀盐酸,使之恰好完全反应(鸡蛋壳中杂质不与稀盐酸反应),测得烧杯中的反应剩余物的质量(m)与反应时间(t)的关系如图所示(忽略水蒸气的挥发),试计算: