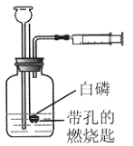
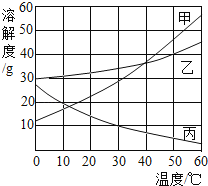
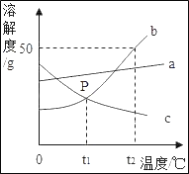
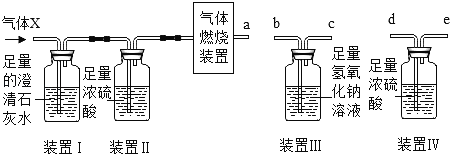
题目内容
【题目】小明同学测定该胃药中NaHCO3含量的过程如下,取10粒该药剂研碎后放入烧杯中,加入50g水后充分搅拌,再向其中滴加11.5克稀盐酸恰好反应(药品中的其它成分既不溶于水,也不与稀盐酸反应),形成NaCl的不饱和溶液,称得反应后烧杯内物质的总质量为64.3克。求:

(1)反应完成后生成气体的质量_____
(2)求该药品中NaHCO3的质量分数_____
(3)求反应后所得溶液的溶质质量分数_____(精确到0.1%)
【答案】2.2g 84% 4.6%
【解析】
根据质量守恒定律可知,过程中质量的减少是因为生成了二氧化碳,所以可以求算二氧化碳的质量,根据二氧化碳的质量和对应的化学方程式求算碳酸氢钠和生成的氯化钠的质量,进而求算对应的质量分数。
解:根据质量守恒定律可得,生成的二氧化碳的质量为0.5g×10+50g+11.5g﹣64.3g=2.2g;
设参加反应的碳酸氢钠的质量为x,生成的氯化钠的质量为y,
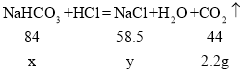
![]() x=4.2g;
x=4.2g;
![]() y=2.925g;
y=2.925g;
该药品中NaHCO3的质量分数为![]() ×100%=84%;
×100%=84%;
反应后所得溶液的溶质质量分数为![]() ×100%≈4.6%;
×100%≈4.6%;
答:(1)反应完成后生成气体的质量为2.2g;
(2)该药品中NaHCO3的质量分数为84%;
(3)反应后所得溶液的溶质质量分数为4.6%。

【题目】厨房中的实验室。
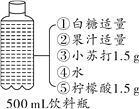
(1)在厨房中可以自制碳酸饮料,配料表如图所示。产生的二氧化碳气体是配料表中的柠檬酸与____反应生成的,人体胃液中的酸也可以与该物质反应,其方程式为____________。
(2)紫罗兰的花瓣汁液呈紫色,将它分别滴加到盛有下列溶液的试管中有如下现象:
溶液 名称 | 白醋 | 稀盐 酸 | 氯化钠 溶液 | 蒸馏水 | 石灰水 | 氢氧化 钠溶液 |
紫罗 兰 | 红色 | 红色 | 紫色 | 紫色 | 蓝色 | 蓝色 |
将紫罗兰花瓣汁液滴入肥皂水中溶液呈蓝色,说明肥皂水显________性。