题目内容
【题目】如图是从海水中提纯精盐的流程:
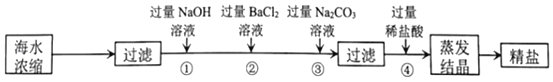
(除NaCl外,还有泥沙、MgCl2、CaCl2、Na2SO4)
(1)加入过量Na2CO3溶液的目的是除去CaCl2和_____,流程中不能用过量稀硫酸代替过量稀盐酸的原因是_____。
(2)写出④中发生反应的化学方程式:_____(写出其中一个即可)。
【答案】BaCl2 会使最后得到的盐中含有硫酸根离子 HCl+NaOH═NaCl+H2O、Na2CO3+2HCl═2NaCl+H2O+CO2↑
【解析】
这是一道除杂类的实验框图题,要利用物质性质(包括物理性质和化学性质)的不同进行实验。除杂质题至少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质。由题图可知,欲除去NaCl中泥沙、MgCl2、CaCl2、Na2SO4等杂质,泥沙不溶于水,过滤可以除去,再根据镁离子与氢氧根离子作用生成Mg(OH)2沉淀,硫酸根离子与钡离子作用生成BaSO4沉淀,钙离子与碳酸根离子作用生成CaCO3沉淀,然后过滤到三种沉淀,但要放在所有的沉淀操作之后,加碳酸钠要放在加氯化钡之后,可以将过量的钡离子沉淀,最后再用盐酸处理溶液中的剩余的碳酸根离子和氢氧根离子,进行分析解答。
(1)镁离子用氢氧根离子沉淀,加入过量的氢氧化钠溶液可以将镁离子沉淀;硫酸根离子用钡离子沉淀,加入过量的氯化钡溶液可以将硫酸根离子沉淀;至于先除镁离子,还是先除硫酸根离子都可以;钙离子用碳酸根离子沉淀,除钙离子加入过量的碳酸钠溶液转化为沉淀,但是加入碳酸钠溶液要放在加入的氯化钡溶液之后,这样碳酸钠会除去反应剩余的氯化钡。故加入过量Na2CO3溶液的目的是除去CaCl2和过量的BaCl2。
流程中不能用过量稀硫酸代替过量稀盐酸,因为第二次过滤所得滤液中,有剩余NaOH、Na2CO3,加入稀硫酸后会反应生成Na2SO4,最后得到的氯化钠不纯。
(2)完全反应后,再进行过滤,最后再加入盐酸除去反应剩余的氢氧根离子和碳酸根离子,④中稀盐酸与氢氧化钠溶液、碳酸钠溶液反应,反应的化学方程式分别是HCl+NaOH═NaCl+H2O、Na2CO3+2HCl═2NaCl+H2O+CO2↑。

【题目】下表是 NaHCO3和NH4Cl在不同温度下的溶解度。下列说法不正确的是( )
温度/℃ | 20 | 30 | 40 | 50 | |
溶解度/g | NaHCO3 | 10.0 | 11.0 | 13.0 | 14.0 |
NH4Cl | 35.0 | 39.0 | 43.0 | 48.0 | |
A.20℃时,配制等质量的 NaHCO3和NH4Cl饱和溶液,NH4Cl需要水少
B.饱和氨盐水吸收CO2后生成的 NaHCO3和NH4Cl,NaHCO3先结晶析出
C.20℃时,NaHCO3饱和溶液的溶质质量分数为10%
D.50℃时,148g NH4Cl饱和溶液降温到20℃,析出13 g NH4Cl晶体