题目内容
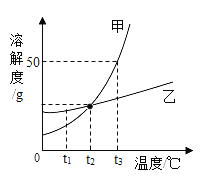
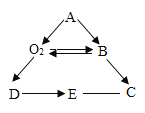
【题目】A~E为初中化学中常见的五种物质,其中B常温下是液体,D是黑色固体,E溶液呈蓝色,它们之间存在如图所示的关系。D与另一物质反应生成E,另一物质的类别是___(填“酸”“碱”“盐”或“氧化物”);A生成B和O2的化学方程式为___;E与C反应的化学方程式为___。
【答案】氧化物  Ca(OH)2+CuSO4=Cu(OH)2↓+CaSO4
Ca(OH)2+CuSO4=Cu(OH)2↓+CaSO4
【解析】
B常温下是液体,因此B是水;过氧化氢在二氧化锰做催化剂的条件下生成水和氧气,因此A是过氧化氢;D是黑色固体,铜和氧气在点燃的条件下生成黑色的氧化铜,氧化铜和硫酸反应生成硫酸铜蓝色溶液和水,E溶液呈蓝色,因此D是氧化铜,属于氧化物;过氧化氢在二氧化锰做催化剂的条件下生成水和氧气,化学方程式是: ;硫酸铜和氢氧化钙反应生成氢氧化铜蓝色沉淀和硫酸钙,化学方程式是:Ca(OH)2+CuSO4=Cu(OH)2↓+CaSO4。
;硫酸铜和氢氧化钙反应生成氢氧化铜蓝色沉淀和硫酸钙,化学方程式是:Ca(OH)2+CuSO4=Cu(OH)2↓+CaSO4。

 名校课堂系列答案
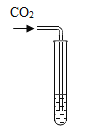
名校课堂系列答案【题目】化学实验活动课上,同学们利用了如图所示实验探究氢氧化钙的性质。
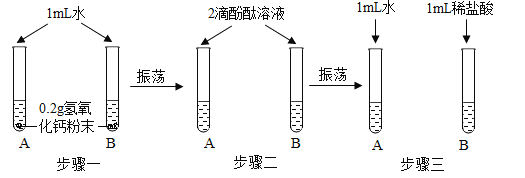
(1)上述三个步骤的A试管中固体始终无明显减少,那么能说明A试管的水中溶有氢氧化钙的现象是__________。
(2)步骤三试管B中溶液变无色,发生反应的化学方程式_______________。
小明的实验:小明直接把稀盐酸滴入盛有氢氧化钙溶液的试管中,始终没有看到明显变化。
(提出问题)小明实验后试管中溶质的成分是什么?
(查阅资料)CaCl2溶液显中性。
(猜想与假设)针对疑问,甲组同学猜想如下:
猜想I:只有CaCl2猜想Ⅱ有________
猜想Ⅲ:有CaCl2和Ca(OH)2
猜想Ⅳ:有CaCl2、HCl和Ca(OH)2
乙组同学对以上猜想提出质疑,认为猜想Ⅳ不合理,其理由是_____________
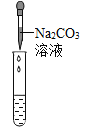
(实验探究)为了验证其余猜想,各小组进行了下列三个方案的探究。
实验方案 | 滴加紫色石蕊试液 | 通入CO2 | 滴加Na2CO3 |
实验操作 |
|
|
|
实验现象 | _________ | __________ | 产生白色沉淀 |
实验结论 | 溶液中含有Ca(OH)2 | 溶液中含有Ca(OH)2 | 溶液中含有Ca(OH)2 |
(得出结论)通过探究,全班同学一致确定猜想Ⅲ是正确的。
(评价反思)丙组同学认为滴加Na2CO3溶液产生白色沉淀,并不能证明溶液中一定含有Ca(OH)2,请你帮助他们说明原因_____________。
【题目】小明拿起家中的水壶准备煮水时,发现壶内有些白色的固体。为了探究其成分,与兴趣小组同学查阅资料获知:这些白色的固体是水垢,它可能是因为水中含有Ca(HCO3)2和Mg(HCO3)2等可溶性物质在加热时生成了CaCO3和Mg(OH)2。
(1)含有较多Ca(HCO3)2的水称_____(填“硬水”或“软水”),加热Ca(HCO3)2时发生反应的化学方程式为_____。
(2)小明和小欣对水垢的成分提出猜想。
小明认为只有CaCO3,
小欣认为只有Mg(OH)2,
你的猜想是:_____
(3)小明为了证明自己的猜想,设计如下实验方案:
实验操作 | 现象 | 结论 |
①取少量水垢于试管中,加入过量的_____。 | 观察到_____(写现象);反应的化学方程式_____。 | 水垢中有CaCO3 |
②向①反应后的试管中滴加2~3滴氢氧化钠溶液 | 观察到_____(写现象)。 | 水垢中没有Mg(OH)2,小明的猜想成立。 |
(反思评价)小欣不认可小明的结论,认为他的实验操作有缺陷,原因是_____。