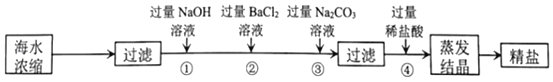
��Ŀ����
����Ŀ��ij����С���ͬѧ��ʯ�ҳ�����һ�麬���ʵ���ʯ������ȡ�Ȼ��ƣ����ȳƵ�����������Ϊ14g��Ȼ�������ʯ�ҷ����ձ��У������ձ��м���146g��������Ϊ10%��ϡ���ᣬǡ����ȫ��Ӧ�����ʲ���Ӧ��Ҳ������ˮ�����ѷ�Ӧ���Һ����ˣ���ֽ�����µĹ������ʾ�ϴ�ӡ������Ƶ���������Ϊ2.8g����������Ǽ��㣺
��1�������ʯ�ҵĴ��ȣ�_____��
��2���ܹ��Ƶ��Ȼ��ƶ��ٿˣ�_____��
���𰸡�80% 22.2g
��������
��1���������ʲ���ϡ���ᷴӦ��ֻ�������ƺ�ϡ���ᷴӦ�����Կɸ��ݷ�Ӧ��ʣ��������������������Ƶ�������������������Ƶ�����������
��2��146g��������Ϊ10%��ϡ����ǡ������������ȫ��Ӧ���ɸ��ݻ�ѧ����ʽ���������Ȼ��Ƶ�������
�ⷨһ���������Ȼ��Ƶ�����Ϊx
CaO��������14g��2.8g��11.2g
��ʯ�ҵĴ��ȣ�![]() ��100%=80%
��100%=80%
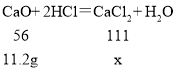
![]() ��x=22.2g
��x=22.2g
�ⷨ������μӷ�Ӧ������������Ϊx�����ɵ��Ȼ�������Ϊy

![]() ��x=11.2g��y=22.2g
��x=11.2g��y=22.2g
��ʯ�ҵĴ��ȣ� ![]() ��100%=80%
��100%=80%
�𣺣�1�������ʯ�ҵĴ�����80%����2���ܹ��Ƶ��Ȼ���22.2g��

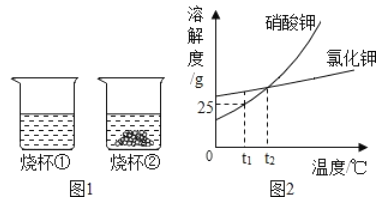
����Ŀ��NaOH��Na2CO3�ֱ���ˮ���ƾ��е��ܽ�����±���ʾ,���ͼ����������˵����ȷ����
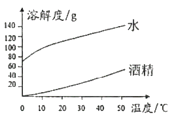
�� | NaOH | Na2CO3 | ||
20�� | 40�� | 20�� | 40�� | |
ˮ | 109g | 129g | 21.8g | 49g |
�ƾ� | 17.3g | 40g | ���� | ���� |
A. ͼ��ʾNa2CO3��ˮ���ƾ��е��ܽ������
B. ��CO2ͨ������NaOH�ľƾ���Һ��,����������
C. 40��ʱ,��50gNaOHͶ�뵽100g�ƾ��У��γɱ�����Һ
D. 20������40��ʱ,NaOH��ˮ�е��ܽ�ȱ仯����Na2CO3��ˮ�е��ܽ�ȱ仯