题目内容
【题目】根据质量守恒定律的有关内容回答下列问题:
①15 mL酒精与15 mL水混合后的体积___(填“大于”“小于”或“等于”)30 mL,这是因为 __________,该变化_______(填“能”或“不能”)用质量守恒定律解释,理由是__________________________。
②将6 g碳在18 g氧气中燃烧,完全反应后得到的二氧化碳质量_______________(填“大于”“小于”或“等于”)24 g,这是因为__________________________________________。
【答案】小于 分子之间有间隔 不能 该变化为物理变化,质量守恒定律适用于化学变化 小于 根据化学方程式可知:6g碳与16g氧气恰好完全反应,得到的二氧化碳质量为22g
【解析】
(1)因为分子之间有间隙,所以15mL酒精与15 mL水混合后,酒精分子和水分子互相填充间隙,使得总体积小于30 mL;该变化是物理变化,不能用质量守恒定律解释;理由是质量守恒定律适合于任何化学变化;
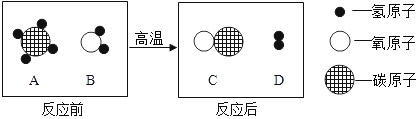
(2)碳与氧气反应的方程式为C+O2![]() CO2,由方程式可知,12份质量的碳完全燃烧需要32份质量的氧气,则6g碳完全燃烧需要16g氧气,生成二氧化碳的质量为6g+16g=22g,小于24。
CO2,由方程式可知,12份质量的碳完全燃烧需要32份质量的氧气,则6g碳完全燃烧需要16g氧气,生成二氧化碳的质量为6g+16g=22g,小于24。

练习册系列答案
相关题目