题目内容
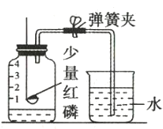
【题目】实验室制取某些气体所需的装置如图所示,请回答下列问题。
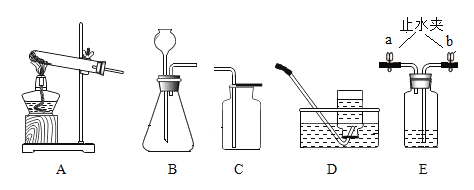
(1)实验室制取二氧化碳气体应选择的发生装置是_____________(填选项字母),反应的化学方程式为______________。
(2)选择收集气体方法时,必须考虑的气体性质有______________(填序号)。
①颜色
②密度
③溶解性
④可燃性
(3)若用装置 E 除去氧气中混有水蒸气,瓶中应盛放的是_____________,气体从 _____________(填“a”或“b”)导管通入瓶内。
【答案】B ![]() ②③ 浓硫酸 b
②③ 浓硫酸 b
【解析】
(1)实验室用大理石和稀盐酸制取二氧化碳,固液反应,不加热,故选择:B;
碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳,方程式为:![]() ;
;
(2)选择收集气体方法时需要考虑气体的密度和溶解性,密度比空气大用向上排空气法收集,密度比空气小用向下排空气法收集,难溶于水的气体可用排水法收集;故选:②③;
(3)除去氧气中混有水蒸气可用浓硫酸干燥,气体长进短出,故填:浓硫酸,b。

 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案【题目】有一种石灰石样品(杂质既不溶于水也不与盐酸反应),某化学兴趣小组为了测定该石灰石样品中碳酸钙的质量分数,取12克样品放入烧杯中,再取100克稀盐酸分5次加入烧杯中,充分反应后,测得实验数据如下:
第一次 | 第二次 | 第三次 | 第四次 | 第五次 | |
加入稀盐酸的质量(g) | 20 | 20 | 20 | 20 | 20 |
反应后烧杯内物质的质量(g) | 30.9 | 49.8 | 68.7 | 87.6 | 107.6 |
计算:(1)碳酸钙中各元素的质量比_____。
(2)完全反应时,生成二氧化碳的总质量为_____克。
(3)样品中碳酸钙的质量质量分数。_____(计算结果精确到0.1%)
【题目】某研究性学习小组以“酸与碱能否发生反应”为课题进行了实验探究。
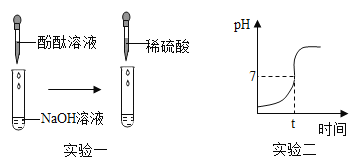
(实验一)
(1)向滴有酚酞试液的NaOH溶液中滴入稀硫酸,观察到溶液颜色由_____,证明硫酸和氢氧化钠发生了反应,该反应的化学方程式为_____。
(2)继续往上述反应后的溶液中逐滴滴入NaOH溶液,不断振荡,如果观察到_____现象,证明了滴加的稀硫酸过量。
(实验二)测量酸和碱反应过程的pH
(1)实验过程中用传感器实时获得溶液的pH,要得到如图所得变化曲线,所进行的操作是_____(填字母)。
A 将稀硫酸溶液逐滴滴加到氢氧化钠溶液中
B 将氢氧化钠溶液逐滴滴加到稀硫酸溶液中
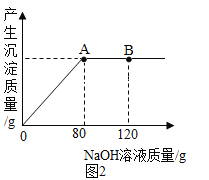
(2)根据如图2溶液pH变化,判断酸和碱发生反应的依据是_____。
(实验三)小组同学经过讨论,一致认为除了上述方法外,还可以按照如表实验方法证明硫酸和氢氧化钠发生了反应。
实验步骤 | 实验现象 | 实验结论 |
取少量氢氧化钠溶液于试管中,加入过量的稀硫酸,再加入少量的氧化铜 | 得到蓝色溶液,无_____ | 氢氧化钠和硫酸发生了化 学反应 |
(拓展延伸)同学们对氢氧化钠溶液和稀硫酸反应后溶液中的溶质成分产生了浓厚的兴趣,于是进行了进一步的探究。
(提出问题)氢氧化钠溶液和稀硫酸反应后溶液中的溶质成分
(提出猜想)猜想一:Na2SO4猜想二:Na2SO4和H2SO4你的合理猜想是:_____。
(进行实验)
实验步骤 | 实验现象 | 实验结论 |
取少量反应后的溶液置于试管中_____ | _____ | 猜想二正确 |
(实验反思)在分析化学反应后所得物质成分时,除考虑生成物外还需要考虑反应物是否有剩余。
【题目】下表列出了20℃时NaCl溶解实验的一组数据
实验序号 | 水的质量/g | 所加NaCl的质量/g | 所得溶液的质量/g |
① | 10 | 2 | 12 |
② | 10 | 3 | 13 |
③ | 10 | 4 | 13.6 |
④ | 10 | 5 | 13.6 |
下列叙述正确的是( )
A.20℃时③所得溶液中NaCl的质量为4 g
B.①所得溶液的溶质的质量分数为20%
C.①②所得溶液是20℃时NaCl的不饱和溶液
D.①②③所得溶液是20℃时NaCl的不饱和溶液