题目内容
【题目】根据如图回答问题。
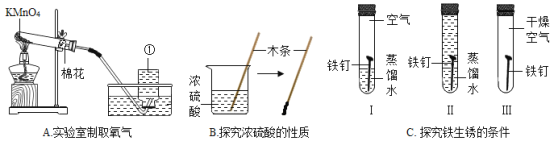
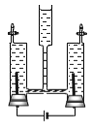
(1)A中仪器①的名称是_____,发生反应的化学方程式是_____。试管中加一团棉花的作用是_____。
(2)B中观察到的现象是_____。
(3)C中会出现明显现象的是试管_____(填序号),试管Ⅱ中的蒸馏水需要煮沸、迅速冷却后再使用,目的是_____。该实验说明铁生锈是铁和空气中的_____共同作用的结果。
【答案】集气瓶 2KMnO4![]() K2MnO4+MnO2+O2↑ 防止加热时高锰酸钾粉末进入导管 小木条沾有硫酸的部位会变黑 Ⅰ 把水中的氧气排干净 氧气、水
K2MnO4+MnO2+O2↑ 防止加热时高锰酸钾粉末进入导管 小木条沾有硫酸的部位会变黑 Ⅰ 把水中的氧气排干净 氧气、水
【解析】
(1)仪器①的名称是集气瓶;高锰酸钾在加热的条件下分解为锰酸钾、二氧化锰和氧气;为了防止高锰酸钾颗粒进入导气管,需要在试管口处放置一团棉花;故填:集气瓶;2KMnO4![]() K2MnO4+MnO2+O2↑;防止加热时高锰酸钾粉末进入导管;
K2MnO4+MnO2+O2↑;防止加热时高锰酸钾粉末进入导管;
(2)浓硫酸具有脱水性,实验中会观察到小木条沾有硫酸的部位会变黑。故填:小木条沾有硫酸的部位会变黑;
(3)铁与水和氧气同时接触会生锈,Ⅰ中的铁钉与氧气、水同时接触,发生了锈蚀;在Ⅱ中铁只与水接触不生锈;在Ⅲ中铁钉只与氧气接触没生锈,试管Ⅱ中的蒸馏水需要煮沸、迅速冷却后再使用,目的是除尽水中的氧气,并控制变量,使对照组温度一致;由实验可知,铁生锈是铁和空气中的水蒸气、氧气共同作用的结果。故填:Ⅰ;把水中的氧气排干净;氧气、水。

 备战中考寒假系列答案
备战中考寒假系列答案【题目】如图的加热袋常用于野外加热食物。加热袋中的固体粉末含镁粉、铁粉和氯化钠,使用时向其中加入水袋中的水,即可产生大量热。实验小组针对放热过程中的反应原理展开探究。


【查阅资料】
常温下镁粉能与水发生置换反应,且放热。
【进行实验】
同学们用下图所示装置进行模拟实验:分别取不同成分的固体粉末放入甲中,通过分液漏斗向其中均加入8 mL水,读取甲中所得固液混合物的最高温度,实验记录如下表:
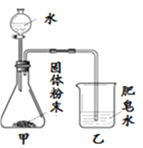
(实验时的室温为22.8℃)
实验序号 | A | B | C | D | E | F |
固体成分 | Mg | Fe | Mg+Fe | Mg+NaCl | Fe+NaCl | Mg+Fe+NaCl |
乙中现象 | 少量肥皂泡,难以点燃 | ______ | 少量肥皂泡,难以点燃 | 较多肥皂泡,点燃有爆鸣声 | 无肥皂泡 | 大量肥皂泡,点燃有爆鸣声 |
混合物温度 | 23.1℃ | 22.8℃ | 23.1℃ | 24.2℃ | 22.8℃ | 27.2℃ |
【解释与结论】
(1)实验B,乙中现象为_______________。
(2)实验A证明了镁粉与水能反应,完成该反应的化学方程式Mg+2H2O=____+H2 ![]() 。
。
(3)使镁粉与水迅速反应并放热的最佳方法是向镁粉中加入_____________。
【反思改进】
(4)同学们分析实验数据发现,升高的温度没有达到食品加热袋的效果,其可能的原因是___________。
(5)同学们根据实验结果进一步猜测,实验F中的反应结束后,甲中剩余固体混合物中仍然含有铁粉,检验其铁粉存在的的验方案为:取少量固体混合物________。
(6)从上述实验初步得出“NaCl溶于水没有热量的变化”的结论,依据的两个实验是(填实验序号)______________。