��Ŀ����
����Ŀ����ͼ�ļ��ȴ�������Ұ�����ʳ����ȴ��еĹ����ĩ��þ�ۡ����ۺ��Ȼ��ƣ�ʹ��ʱ�����м���ˮ���е�ˮ�����ɲ��������ȡ�ʵ��С����Է��ȹ����еķ�Ӧԭ��չ��̽����


���������ϡ�
������þ������ˮ�����û���Ӧ���ҷ��ȡ�
������ʵ�顿
ͬѧ������ͼ��ʾװ�ý���ģ��ʵ�飺�ֱ�ȡ��ͬ�ɷֵĹ����ĩ������У�ͨ����Һ©�������о�����8 mLˮ����ȡ�������ù�Һ����������¶ȣ�ʵ���¼���±���
��ʵ��ʱ������Ϊ22.8�棩
ʵ����� | A | B | C | D | E | F |
����ɷ� | Mg | Fe | Mg+Fe | Mg+NaCl | Fe+NaCl | Mg+Fe+NaCl |
�������� | ���������ݣ����Ե�ȼ | ______ | ���������ݣ����Ե�ȼ | �϶�����ݣ���ȼ�б����� | ������ | ���������ݣ���ȼ�б����� |
������¶� | 23.1�� | 22.8�� | 23.1�� | 24.2�� | 22.8�� | 27.2�� |
����������ۡ�
��1��ʵ��B����������Ϊ_______________��
��2��ʵ��A֤����þ����ˮ�ܷ�Ӧ����ɸ÷�Ӧ�Ļ�ѧ����ʽMg+2H2O=____+H2 ![]() ��
��
��3��ʹþ����ˮѸ�ٷ�Ӧ�����ȵ���ѷ�������þ���м���_____________��
����˼�Ľ���
��4��ͬѧ�Ƿ���ʵ�����ݷ��֣����ߵ��¶�û�дﵽʳƷ���ȴ���Ч��������ܵ�ԭ����___________��
��5��ͬѧ�Ǹ���ʵ������һ���²⣬ʵ��F�еķ�Ӧ��������ʣ�������������Ȼ�������ۣ����������۴��ڵĵ��鷽��Ϊ��ȡ������������________��
��6��������ʵ������ó���NaCl����ˮû�������ı仯���Ľ��ۣ����ݵ�����ʵ���ǣ���ʵ����ţ�______________��
���𰸡� ������ Mg(OH)2 ���� ʳ�� û�б��´�ʩ������ɢʧ ����ϡ���ᣬ�����ݲ�������Һ��dz��ɫ��֤�������� B E
�����������⿼����ʵ��̽�����ʵ����ʻ�仯��������ѧ����ʽ����д��ͨ��ʵ�����Ϻ�ʵ��������õ�����ȷ�Ľ��ۣ�Ҫ����������ۺ�������
��1����������ˮ��Ӧ������ˮ���ʱ�������ݲ�����
��2�����ݻ�ѧ����ʽ����Ӧǰþԭ�ӡ���ԭ�ӡ���ԭ�ӵ���Ŀ�ֱ�Ϊ1��4��2����Ӧ����ԭ�ӵ���ĿΪ2�����ݻ�ѧ�仯��ԭ�ӵ���Ŀ������䣬�����ԭ�ӿɹ���Mg(OH)2�����Mg(OH)2��
��3��ͨ���������и�����֮��ķ�Ӧ�����ߵ��¶ȿ�֪��ʹþ����ˮѸ�ٷ�Ӧ�����ȵ���ѷ�������þ���м���Fe��NaCl��
��4��û�б��´�ʩ������ɢʧ��������١���Ȳ����ʵ�ԭ������¶����������ԣ����Է���ʵ�����ݷ��֣����ߵ��¶Ȳ����Լ���ʳ�����ܵ�ԭ���ǣ�û�б��´�ʩ������ɢʧ��
��5�����������ᷴӦ�����Ȼ����������������Բ����ʵ�鷽���ǣ�ȡ���������������������м�������ϡ���ᣬ�����ܽ⣬������ð������Һ��dz��ɫ��֤����Fe��
��6��B��E����ʵ��û�з�����ѧ�仯���¶�û���������ߣ�˵��NaCl����ˮû�������ı仯��

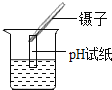
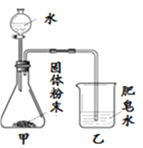
����Ŀ��ʵ������ͭ�Կ���Ҫ�ɷ�ΪCu2S��������Fe2O3��SiO2�����ʣ��Ʊ�ij�ּ�ʽ̼��ͭ��Cua(OH)b(CO3)cdH2O������Ҫʵ����������ͼ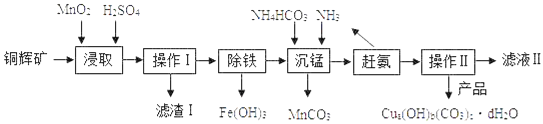
��1��ʵ���ҽ��в���I�Ͳ���IIʱ���õ��IJ��������У����������ձ���__________��
��2������ȡ�������з�����Ӧ��I��II�������з�ӦIΪ��2MnO2+Cu2S+��H2SO4=2MnSO4+2CuSO4+S��+4H2O���ڡ��еĻ�ѧ��������________��
��3������ȡ�������У���һ��ӦII�Ļ�ѧ����ʽΪ________________��
��4������I�ijɷ�ΪMnO2��S��___________��
��5����֪����������������������ʽ����ʱ��Һ��pH���±���
������ | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | Mn(OH)2 |
��ʼ���� | 7.5 | 2.7 | 5.2 | 8.3 |
��ȫ���� | 9.7 | 3.2 | 6.4 | 9.8 |
�������������У��������˵�pH��ΧΪ_____________��
����Ŀ��ʳ��(NaCl)��̼����(Na2CO3)����ʯ��(CaO)������Ƥ���������Ҫԭ�ϡ���������ʱ��������ԭ�ϼ�������ˮ�У������Ͼ��ȼ��ɡ�
(1)����������ʱ����ʯ����ˮ��Ӧ�Ļ�ѧ����ʽ��__________________��
����������ʱ����̼���Ʒ�Ӧ��������_____________________(д��ѧʽ)��
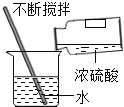
(2)ij��ѧ��ȤС���Ӱ����Һ����ǿ��������չ��̽�����ò�ͬ�¶ȵ�ˮ�������������������ֱ�Ϊ2%��6%��10%��̼������Һ�����β�����Һ��pH����¼�������±���
ʵ���� | a1 | a2 | a3 | b1 | b2 | b3 | c1 | c2 | c3 |
������������ | 2% | 2% | 2% | 6% | 6% | 6% | 10% | 10% | 10% |
ˮ���¶�(��) | 20 | 40 | 60 | 20 | 50 | 60 | 20 | 50 | 70 |
��ҺpH | 10.90 | 11.18 | 11.26 | 11.08 | 11.27 | 11.30 | 11.22 | X | 11.50 |
��������������ݻش�
����Һ������ǿ����___________(��ʵ����)
��ʵ��a1��b1��c1��ʵ��Ŀ����________________________��
������ͬ�������£�һ���¶ȷ�Χ�ڣ��¶���̼������ҺpH�Ĺ�ϵ��____________________��
�ܱ�����X����ֵ������____________(��ѡ��)��
A��11.20 B��11.25 C��11.37 D��11.62