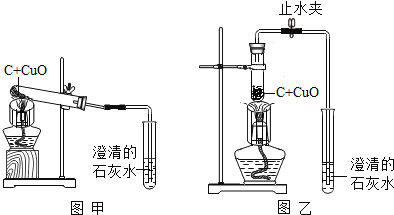
题目内容
【题目】请结合下列实验常用装置,回答有关问题。
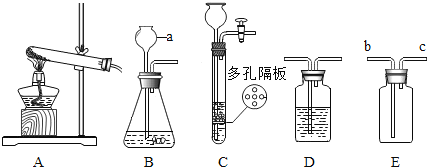
(1)写出图中标有字母的仪器名称:a_______________。
(2)若用高锰酸钾制取氧气,应选用的发生装置是__________(填“A”“B”或“C”),在加入药品前,应首先____________,反应的化学方程式是___________________。
(3)若要制取二氧化碳,在B装置中装有石灰石,那么a中应加入_____________,反应的化学方程式是___________________。
(4)甲烷是一种密度比空气小、难溶于水的气体。实验室常用无水醋酸钠固体和碱石灰固体共热制取甲烷,应该选择的发生装置是_____________(选填装置序号)。若选用E装置用于排空气法收集甲烷,甲烷应从____________(填“b”或“c”)端通人。
【答案】长颈漏斗 A 检验装置的气密性 2KMnO4![]() K2MnO4+MnO2+O2↑ 稀盐酸 CaCO3+2HCl═CaCl2+H2O+CO2↑ A c
K2MnO4+MnO2+O2↑ 稀盐酸 CaCO3+2HCl═CaCl2+H2O+CO2↑ A c
【解析】
(1)a为长颈漏斗;
(2)若用高锰酸钾制取氧气,需要固固加热装置,即A装置;在加入药品前,应首先检查装置气密性,高锰酸钾制取氧气反应的方程式为:2KMnO4![]() K2MnO4+MnO2+O2↑;
K2MnO4+MnO2+O2↑;
(3)实验室制取二氧化碳用石灰石和稀盐酸,长颈漏斗可添加液体,石灰石主要成分碳酸钙和盐酸反应生成氯化钙、水和二氧化碳,反应方程式是:CaCO3+2HCl═CaCl2+H2O+CO2↑;
(4)用无水醋酸钠固体和碱石灰固体共热制取甲烷,属于固体加热型,故选发生装置A,甲烷密度比空气小,用排空气法时,应从短管进气。

【题目】(一)营养与健康息息相关
(1)下表是100g某食品的部分营养成分:
总热量 | 蛋白质 | 糖类 | 油脂 | 水 | 铁 | 磷 | 钙 |
2060 kJ | 50 g | 20g | 20g | 5g | 5.6 mg | 3.3 mg | 8mg |
该食品中没有列出的营养素是___________。
(2)为了防止儿童患佝偻病,必须摄入富含___________元素的食物。
(二)利用化学知识解释一些现象。
(1)为保证安全,进入久未开启的菜窖前,必须先做___________实验。
(2)防毒面具的滤毒罐里盛放活性炭,这是利用了活性炭的_____________性。
(3)工业上用一氧化碳和赤铁矿炼铁,该反应的化学方程式为 ________________。